
Proprietăți și utilizări ale acidului de iod (HIO2)

acid iodat Este un compus chimic cu formula HIO2. Acest acid, precum și sărurile sale (cunoscute sub numele de iodite), sunt compuși extrem de instabili care au fost observați, dar niciodată izolați.
Este un acid slab, ceea ce înseamnă că nu se disociază complet. La anion, iodul se află în starea de oxidare III și are o structură analogă acidului cloros sau acidului brom, așa cum este ilustrat în figura 1.
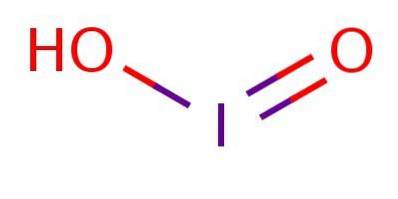
Deși compusul este instabil, acidul de iod și sărurile sale de iodit au fost detectate ca intermediari în conversia dintre ioduri (I-) și iodate (IO3-).
Instabilitatea sa se datorează unei reacții de dismutație (sau disproporție) pentru a forma acid hipoiodoid și acid iodic, care este analog cu acizii clor și brom în felul următor:
2HIO2 -> HIO + HIO3
La Napoli, în 1823, omul de știință Luigi Sementini i-a scris o scrisoare lui E. Daniell, secretarul instituției regale din Londra, unde a explicat o metodă de obținere a acidului iodat..
În scrisoare, el a spus că, având în vedere că formarea acidului azotat a fost, combinarea acidului azotic cu ceea ce el a numit gaz azotat (posibil NDouăO), acidul iodat ar putea fi format în același mod prin reacția acidului iodic cu oxidul de iod, un compus descoperit de el.
Procedând astfel, a obținut un lichid galben-chihlimbar care și-a pierdut culoarea la contactul cu atmosfera (Sir David Brewster, 1902).
Mai târziu, omul de știință M. Wöhler a descoperit că acidul Sementini este un amestec de clorură de iod și iod molecular, deoarece oxidul de iod utilizat în reacție a fost preparat cu clorat de potasiu (Brande, 1828).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 utilizări
- 2.1 Acilarea nucleofilă
- 2.2 Reacții de demutare
- 2.3 Reacții Bray-Liebhafsky
- 3 Referințe
Proprietati fizice si chimice
După cum s-a menționat mai sus, acidul de iod este un compus instabil care nu a fost izolat, astfel încât proprietățile sale fizice și chimice sunt obținute teoretic prin calcule și simulări de calcul (Royal Society of Chemistry, 2015).
Acidul de iod are o greutate moleculară de 175,91 g / mol, o densitate de 4,62 g / ml în stare solidă, un punct de topire de 110 grade Celsius (acid iodat, 2013-2016).
De asemenea, are o solubilitate în apă de 269 g / 100 ml la 20 grade Celsius (fiind un acid slab), are un pKa de 0,75 și are o susceptibilitate magnetică de -48,0 · 10-6 cm3 / mol (Centrul Național pentru Biotehnologie Informații, sf).
Deoarece acidul iodat este un compus instabil care nu a fost izolat, nu există niciun risc de manipulare a acestuia. S-a constatat prin calcule teoretice că acidul de iod nu este inflamabil..
Aplicații
Acilarea nucleofilă
Acidul de iod este utilizat ca nucleofil în reacțiile de acilare nucleofilă. Exemplul este dat cu acilarea trifluoroacetililor, cum ar fi bromura de 2,2,2-trifluoroacetil, clorura de 2,2,2-trifluoroacetil, fluorura de 2,2,2-trifluoroacetil și iodura de 2,2,2-trifluoroacetil pentru a forma iodosilul 2,2,2 trifluoroacetat așa cum este ilustrat în figura 2.1, 2.2, 2.3 și respectiv 2.4.

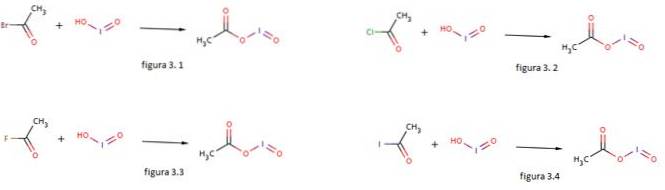
Acidul de iod este, de asemenea, utilizat ca nucleofil pentru formarea acetatului de iodosil prin reacția acestuia cu bromură de acetil, clorură de acetil, fluorură de acetil și iodură de acetil așa cum se arată în figurile 3.1, 3.2, 3.3 și respectiv 3.4 (GNU Free Documentation, sf).
Reacții de demutare
Reacțiile de dezmembrare sau disproporționare sunt un tip de reacție de reducere a oxidului, în care substanța care este oxidată este aceeași care este redusă.
În cazul halogenilor, deoarece aceștia au stări de oxidare de -1, 1, 3, 5 și 7, pot fi obținuți diferite produse ale reacțiilor de dismutație în funcție de condițiile utilizate..
În cazul acidului iodat, exemplul modului în care reacționează pentru a forma acid hipoiodin și acid iodic sub formă.
2HIO2 -> HIO + HIO3
Studii recente au analizat reacția de dismutație a acidului de iod prin măsurarea concentrațiilor de protoni (H+), iodat (IO3-) și cationul hipoiodit acid (HDouăIO+) pentru a înțelege mai bine mecanismul dismutației acidului iodat (Smiljana Marković, 2015).
S-a preparat o soluție conținând speciile intermediare I3+. Un amestec de specii de iod (I) și iod (III) a fost preparat prin dizolvarea iodului (IDouă) și iodat de potasiu (KIO3), în raport 1: 5, în acid sulfuric concentrat (96%). În această soluție apare o reacție complexă, care poate fi descrisă prin reacție:
EuDouă + 3IO3- + 8H+ -> 5IO+ + HDouăSAU
Specia I3+ sunt stabile doar în prezența excesului de iod adăugat. Iodul previne formarea de I3+. Ionul IO+ Se obține sub formă de sulfat de iod (IO) DouăSW4), se descompune rapid în soluție apoasă acidă și se formează I3+, reprezentat ca acid HIODouă sau specia ionică IO3-. Ulterior, a fost efectuată o analiză spectroscopică pentru a determina valoarea concentrațiilor ionilor de interes..
Aceasta a prezentat o procedură pentru evaluarea concentrațiilor de pseudo-echilibru ale ionilor de hidrogen, iodat și H.DouăAM AUZIT+, Specii cinetice și catalitice importante în procesul de disproporționare a acidului de iod, HIODouă.
Reacții Bray-Liebhafsky
Un ceas chimic sau o reacție de oscilație este un amestec complex de compuși chimici care reacționează, în care concentrația unuia sau mai multor componente se modifică periodic sau când apar modificări bruște ale proprietăților după un timp de inducție previzibil.
Acestea sunt o clasă de reacții care servesc ca exemplu de termodinamică fără echilibru, rezultând în stabilirea unui oscilator neliniar. Ele sunt teoretic importante, deoarece arată că reacțiile chimice nu trebuie să fie dominate de un comportament termodinamic de echilibru..
Reacția Bray-Liebhafsky este un ceas chimic descris pentru prima dată de William C. Bray în 1921 și este prima reacție de oscilație într-o soluție omogenă agitată..
Acidul de iod este utilizat experimental pentru a studia acest tip de reacție atunci când este oxidat cu peroxid de hidrogen, găsind un acord mai bun între modelul teoretic și observațiile experimentale (Ljiljana Kolar-Anić, 1992).
Referințe
- Brande, W. T. (1828). Un manual de chimie, pe baza profesorului Brande. Boston: Universitatea din Harvard.
- Documentație gratuită GNU. (s.f.). acid iodat. Adus de la chemsink.com: chemsink.com
- acid iodat. (2013-2016). Adus de pe molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mecanismul reacției Bray-Liebhafsky: efectul oxidării acidului iodat de peroxidul de hidrogen. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Centrul Național pentru Informații despre Biotehnologie. (n.d.). Baza de date compusă PubChem; CID = 166623. Adus de la pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Societatea Regală de Chimie. (2015). Acid iodat ChemSpider ID145806. Adus de la ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). Revista filozofică și Journal of Science din Londra și Edinburgh. londra: universitatea din londra.
- Smiljana Marković, R. K. (2015). Reacția de disproporționare a acidului iodat, HOIO. Determinarea concentrațiilor speciilor ionice relevante H +, H2OI + și IO3 -.



Nimeni nu a comentat acest articol încă.