
Acizi și baze puternice și slabe

O clasificare a acizilor și bazelor în chimie depinde de forța de ionizare a acestor substanțe în mediu apos. A) Da:
- A acidul și o bază sunt puternice atunci când sunt complet ionizați, adică în procesul de ionizare sunt transformați complet în cationi sau ioni pozitivi și în anioni sau ioni negativi.
- Pe de altă parte, un acid și o bază sunt slabi când sunt parțial ionizați în apă, adică în soluție va exista o proporție de cationi, o altă proporție de anioni și o altă proporție de molecule nedisociate.
| Acizi și baze puternice | Acizi și baze slabe | |
|---|---|---|
| Definiție | Substanțe care se ionizează complet în soluție. | Substanțe care se ionizează parțial în soluție. |
| Ionizare | Complet | Parțial |
| Elemente în soluție apoasă | Cationi și anioni în aceeași concentrație. | Cationi, anioni și molecule în diferite proporții. |
| Constanta de ionizare | Elevat | Mic |
| Exemple |
|
|
Acizi și baze puternice
A acidul sau o bază sunt puternice atunci când într-un mediu apos se disociază complet, adică procesul de ionizare este complet și soluția va avea aceeași concentrație de anioni ca și cationii.
Cum ionizezi un acid și o bază puternică??
Un acid puternic, cum ar fi acidul clorhidric HCl, ionizează în următoarele moduri:
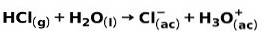
O bază puternică, cum ar fi hidroxidul de sodiu NaOH, ionizează în următoarele moduri:
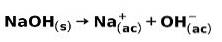
Exemple de acizi puternici și formulele lor
| Acizi tari | Formulă |
|---|---|
| Acid clorhidric | acid clorhidric |
| Acid sulfuric | HDouăSW4 |
| Acid azotic | HNO3 |
| Acid bromhidric | HBr |
| Acid percloric | HClO4 |
| Acid cromic | HDouăCrO4 |
| Acid tetrafluroboric | HBF4 |
Exemple de baze puternice și formulele lor
| Baza puternică | Formulă |
|---|---|
| Hidroxid de sodiu | NaOH |
| Hidroxid de litiu | LiOH |
| Hidroxid de potasiu | KOH |
| Hidroxid de rubidiu | RbOH |
| Hidroxid de cesiu | CsOH |
| Hidroxid de calciu | Ca (OH)Două |
| Hidroxid de bariu | Ba (OH)Două |
| Hidroxid de stronțiu | Sr (OH)Două |
| Hidroxid de aluminiu | Al (OH)3 |
S-ar putea să fiți interesat să vedeți mai multe exemple de acizi și baze.
Acizi și baze slabe
A Acidul sau baza sunt slabe atunci când parțial ionizate în soluție apoasă, adică în soluție există ioni și molecule neionizate.
Cum ionizezi un acid și o bază slabă??
Un acid slab, cum ar fi acidul acetic CH3COOH, este ionizat în următorul mod:
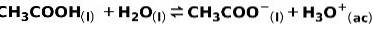
Echilibrul acestei reacții este exprimat de cele două săgeți în direcții opuse.
Când un acid slab se disociază sau se ionizează, se stabilește un echilibru între speciile prezente în soluție; acest lucru poate fi exprimat prin a constanta de ionizare acru:
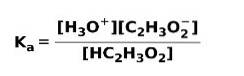
Constanta de ionizare nu este altceva decât raportul dintre înmulțirea concentrației produselor peste înmulțirea concentrației reactanților.
O bază slabă, cum ar fi NH amoniac3, ionizează în felul următor:
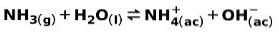
Când o bază slabă se disociază sau se ionizează, se stabilește un echilibru între speciile prezente în soluție; acest lucru poate fi exprimat prin a constanta de ionizare a bazei:
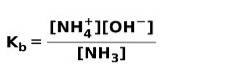
S-ar putea să fiți interesat să cunoașteți diferența dintre acizi și baze.
Exemple de acizi slabi cu formula lor și constanta de ionizare a acidului Kla
| Acid slab | Formulă | Constanta de ionizare |
|---|---|---|
| Acid formic | HDouăCODouă | 1,77 x 10-4 |
| Acid acetic | H3CCOH | 1,75 x 10-5 |
| Acid cianhidric | HOCN | 3,30 x 10-4 |
| Acid cianhidric | HCN | 6,20 x 10-10 |
| Acid hipocloros | HOCl | 3,50 x 10-8 |
| Acid azotat | HNODouă | 4,00 x 10-4 |
| Acid lactic | HC3H5SAU3 | 1,40 x 10-4 |
| Acid carbonic | HDouăCO3 | 4,30 x 10-7 5,60 x 10-unsprezece |
| Acid boric | H3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Exemple de baze slabe cu formula lor și constanta de ionizare de bază Kb
| Baza slabă | Formulă | Constanta de ionizare |
|---|---|---|
| Amoniac | NH3 | 1,75 x 10-5 |
| Metilamina | CH3NHDouă | 4,38 x 10-4 |
| Etilamina | CDouăH5NHDouă | 5,60 x 10-4 |
| Anilină | C6H5NHDouă | 3,80 x 10-10 |
| Piridină | C5H5N | 1,70 x 10-9 |
| Benzilamina | C7H9N | 2,20 x 10-5 |
| Bicarbonat de sodiu | NaHCO | 2,00 x 10-4 |
S-ar putea să fiți interesat să aflați mai multe despre caracteristicile acizilor și bazelor


Nimeni nu a comentat acest articol încă.