
Formula cu clor gazos, efecte, utilizări și riscuri
clor gazos (diclor, clor diatomic, clor molecular sau pur și simplu clor) este un gaz de culoare galben-verzuie, cu miros înțepător și sufocant, necombustibil la temperatura camerei și la presiunea atmosferică.
Este elementul cu cea mai mare afinitate electronică și al treilea cel mai înalt electronegativitate, în spatele doar oxigenului și fluorului. Este extrem de reactiv și un agent oxidant puternic.
Potențialul oxidant ridicat al clorului elementar a dus la dezvoltarea înălbitorilor și dezinfectanților comerciali, precum și a unui reactiv pentru multe procese din industria chimică..
Sub formă de ioni clorură, clorul este necesar pentru toate speciile de viață cunoscute. Dar clorul elementar în concentrații mari este extrem de periculos și otrăvitor pentru toate organismele vii, motiv pentru care a fost folosit în Primul Război Mondial ca primul agent de război chimic gazos..

Este toxic prin inhalare. Inhalarea pe termen lung, a concentrațiilor scăzute sau, pe termen scurt, inhalarea concentrațiilor mari de clor gazos, au efecte dăunătoare asupra sănătății..
Vaporii sunt mult mai grei decât aerul și tind să se așeze în zone joase. Nu arde, dar susține arderea. Este ușor solubil în apă. Contactul cu lichide nelimitate poate provoca degerături de răcire prin evaporare.
Folosit pentru purificarea apei, înălbirea pastei de lemn și obținerea altor substanțe chimice.
Indice articol
- 1 Formula
- 2 Structura 2D
- 3 caracteristici
- 3.1 Proprietăți fizice și chimice
- 3.2 Alerte de reactivitate
- 3.3 Inflamabilitate
- 3.4 Reactivitate
- 3.5 Toxicitate
- 4 utilizări
- 5 Efecte clinice
- 6 Siguranță și riscuri
- 6.1 Clasele de pericol GHS
- 6.2 Coduri de declarații de precauție
- 7 Referințe
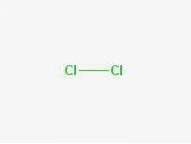
Formulă
Formulă: Cl-Cl
numar CAS: 7782-50-5
Structura 2D

Caracteristici
Proprietati fizice si chimice

Clorul gazos aparține grupului reactiv al agenților oxidanți puternici. Acești compuși reacționează adesea energic cu alți compuși..
Clorul gazos aparține, de asemenea, grupului reactiv al agenților de halogenare puternici, care transferă unul sau mai mulți atomi de halogen în compusul cu care reacționează..
Agenții de halogenare sunt în general acizi și, prin urmare, reacționează, în unele cazuri violent, cu baze.
Mulți dintre acești compuși sunt reactivi la apă și reactivi la aer. Halogenii sunt oxidanți puternic electronegativi și puternici.
Alerte de reactivitate
Clorul gazos este un agent oxidant puternic. Reacționează cu apă. Apa dizolvă clorul gazos, formând un amestec de acid clorhidric și acizi hipoclor.
Inflamabilitate
Poate aprinde alte materiale combustibile (lemn, hârtie, ulei etc.). Amestecarea cu combustibili poate provoca o explozie. Containerul poate exploda la contactul cu focul. Există riscul de explozie (și otrăvire) din cauza acumulării vaporilor săi în interior, în canalizare sau în aer liber..
Amestecurile de hidrogen și clor (5-95%) pot exploda prin acțiunea a aproape orice formă de energie (căldură, lumina soarelui, scântei etc.).
Emite vapori foarte toxici atunci când este încălzit. Atunci când este combinat cu apă sau abur, produce vapori de acid clorhidric toxici și corozivi.
Reactivitate
Clorul reacționează exploziv cu (sau susține arderea) multor materiale obișnuite.
- Clorul aprinde oțelul la 100 ° C în prezența funinginei, oxidului, carbonului sau a altor catalizatori.
- Porniți vata de oțel uscată la 50 ° C.
- Aprindeți sulfurile la temperatura camerei.
- Aprinde (sub forma sa lichidă) cauciuc natural și sintetic.
- Aprinde trialchilborani și dioxid de tungsten.
- Se aprinde în contact cu hidrazină, hidroxilamină și nitrură de calciu.
- Se aprinde sau explodează cu Arsină, Fosfină, Silan, Diboran, Stibină, Fosfor roșu, Fosfor alb, Bor, Carbon activ, Silicon, Arsenic.
- Provoacă aprinderea și o explozie moale atunci când clocotește prin metanol rece.
- Explodează sau se aprinde dacă este amestecat excesiv cu amoniac și încălzit.
- Formează triclorură de azot explozivă la contactul cu reactivul Biuret contaminat cu acid cianuric.
- Formează cu ușurință derivați explozivi ai N-clorului cu aziridină.
Clorul (sub forma sa lichidă sau gazoasă) reacționează cu:
- Alcooli (explozie)
- Aluminiu topit (explozie)
- Silani (explozie)
- Pentafluorură de brom
- Disulfură de carbon (explozie catalizată de fier)
- Clor-2-propin (excesul de clor provoacă o explozie)
- Ftalat de dibutil (explozie la 118 ° C)
- Dietil eter (aprins)
- Dietil zinc (aprins)
- Glicerol (explozie la 70-80 ° C)
- Metan pe oxid galben de mercur (explozie)
- Acetilena (explozie inițiată de lumina soarelui sau încălzire)
- Etilenă pe mercur, oxid de mercur (I) sau oxid de argint (I) (explozie cauzată de căldură sau lumină)
- Benzină (reacție exotermă și apoi detonare)
- Amestec nafta-hidroxid de sodiu (explozie violenta)
- Clorură de zinc (reacție exotermă)
- Ceara (explozie)
- Hidrogen (explozie inițiată de lumină)
- Carbura de fier
- Uraniu și zirconiu
- Hidruri de sodiu, potasiu și cupru
- Staniu
- Pulbere de aluminiu
- Pulbere de vanadiu
- Folie de aluminiu
- Beteală
- Folie de cupru
- Pulbere de calciu
- Sârmă de fier
- Pulbere de mangan
- Potasiu
- Pulbere de antimoniu
- Bismut
- Germaniu
- Magneziu
- Sodiu
- Zinc
Toxicitate
Gazul clorat este otrăvitor și poate fi fatal dacă este inhalat. Contactul poate provoca arsuri ale pielii și ochilor, precum și bronșită sau afecțiuni cronice pulmonare..

Aplicații
Aproximativ 15.000 de compuși de clor sunt folosiți astăzi în comerț. Clorura de sodiu este de departe cel mai comun compus al clorului și este principala sursă de clor și acid clorhidric pentru imensa industrie chimică a clorului..
Dintre tot clorul elementar produs, aproximativ 63% este utilizat la fabricarea compușilor organici, 18% la fabricarea compușilor anorganici ai clorului, iar restul de 19% din clorul produs este utilizat pentru înălbitori și produse de dezinfecție..

Printre compușii organici cei mai semnificativi din punct de vedere al volumului de producție se numără 1,2-dicloroetan și clorură de vinil (produse intermediare în producția de PVC), clorură de metil, clorură de metilen, cloroform, clorură de viniliden, printre altele.
Principalii compuși anorganici includ HCI, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl4 , ZnCl2 și multe altele.
Gazul clorat este utilizat în operațiile de albire industrială, tratarea apelor uzate, fabricarea tabletelor pentru clorinarea piscinelor sau în războiul chimic.
Gazul cu clor (cunoscut sub numele de bertholit) a fost folosit pentru prima dată ca armă în primul război mondial de către Germania.
După prima utilizare, ambele părți din conflict au folosit clorul ca armă chimică, dar în curând a fost înlocuit cu fosgen și gaz muștar, care sunt mai letale..
Gazul cu clor a fost, de asemenea, utilizat în timpul războiului din Irak, în provincia Anbar, în 2007.
Efecte clinice
Clorul gazos este una dintre cele mai frecvente expuneri iritante la inhalare profesională și de mediu. Studii recente au raportat că amestecul de înălbitor (înălbitor, produs în principal pe bază de hipoclorit de sodiu) cu alte produse de curățare, este cea mai frecventă cauză (21% din cazuri) a expunerii la inhalare unică raportată în centrele de control al otrăvurilor..
Principalele efecte toxice se datorează mai degrabă deteriorării țesuturilor locale decât absorbției sistemice. Se consideră că leziunea celulară rezultă din oxidarea grupelor funcționale pe componentele celulare; la reacții cu apă în țesuturi pentru a forma acid hipocloros și acid clorhidric; și generarea de radicali liberi de oxigen (deși această idee este acum controversată).
În intoxicația ușoară până la moderată există: tuse, dificultăți de respirație, dureri în piept, senzație de arsură în gât și în zona retrosternală, greață sau vărsături, iritații oculare și nazale, sufocare, slăbiciune musculară, amețeli, disconfort abdominal și cefalee.
În otrăvirea severă, există: edem al căilor respiratorii superioare, laringospasm, edem pulmonar sever, pneumonie, hipoxemie persistentă, insuficiență respiratorie, leziuni pulmonare acute și acidoză metabolică.
Expunerea cronică la gazul de clor este una dintre cele mai frecvente cauze ale astmului profesional. Poate provoca dispnee, palpitații, dureri în piept, sindrom reactiv de disfuncție a căilor respiratorii superioare, eroziune a smalțului dinților și prevalență crescută a sindroamelor virale. Expunerea cronică la 15 ppm determină tuse, hemoptizie, dureri în piept și dureri în gât.
Expunerea cutanată poate provoca eritem al pielii, durere, iritații și arsuri. Expunerea severă poate provoca colaps cardiovascular și stop respirator. În concentrații mari, pot apărea sincope și moarte aproape imediată. Clorul (sub formă de hipoclorit) este teratogen la animalele experimentale.
Siguranță și riscuri
Declarații de pericol ale Sistemului global armonizat de clasificare și etichetare a substanțelor chimice (GHS).
Sistemul global de armonizare a clasificării și etichetării substanțelor chimice (GHS) este un sistem agreat la nivel internațional, creat de Organizația Națiunilor Unite conceput pentru a înlocui diferitele standarde de clasificare și etichetare utilizate în diferite țări prin utilizarea unor criterii consistente la nivel global (Nations United, 2015 ).
Clasele de pericol (și capitolul corespunzător al GHS), standardele de clasificare și etichetare și recomandările pentru gazul de clor sunt după cum urmează (Agenția Europeană pentru Produse Chimice, 2017; Națiunile Unite, 2015; PubChem, 2017):
Clasele de pericol GHS
H270: Poate provoca sau intensifica focul; Oxidant [Pericole Gaze oxidante - Categoria 1]
H280: Conține gaz sub presiune; Poate exploda dacă este încălzit [Gaz de avertizare sub presiune - gaz comprimat, gaz lichefiat, gaz dizolvat]
H315: Provoacă iritarea pielii [Atenție Coroziunea / iritarea pielii - Categoria 2]
H319: Provoacă iritarea gravă a ochilor [Atenție Leziuni oculare grave / iritarea ochilor - Categoria 2A]
H330: Fatal prin inhalare [Pericol Toxicitate acută, inhalare - Categoria 1, 2]
H331: Toxic prin inhalare [Pericol Toxicitate acută, inhalare - Categoria 3]
H335: Poate provoca iritații ale căilor respiratorii [Atenție Toxicitate specifică a organelor țintă, expunere simplă; Iritarea căilor respiratorii - Categoria 3]
H400: Foarte toxic pentru viața acvatică [Avertisment Periculos pentru mediul acvatic, pericol acut - Categoria 1]
H410: Foarte toxic pentru organismele acvatice cu efecte de lungă durată [Avertisment Periculos pentru mediul acvatic, pericol pe termen lung - Categoria 1]
[PubChem, 2017]
Coduri de declarații de precauție
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P3 P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 și P501.
Referințe
- Benjah-bmm27 (2007). Diclor-gaz-3D-vdW [imagine]. Recuperat de pe: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [imagine]. Recuperat de pe: commons.wikimedia.org.
- ChemIDplus (2017) Structura 3D 7782-50-5 - Clor [imagine] Recuperat de la: chem.nlm.nih.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Foaie de date a grupului reactiv. Agenți oxidanți, puternici. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Oelen, W., (2005). Clor gazos într-o sticlă [imagine]. Recuperat de pe: commons.wikimedia.org.
- Sargent, J., (1918). Gassed [imagine]. Recuperat de pe: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [imagine]. Recuperat de pe: commons.wikimedia.org.
- Wikipedia (2017). Clor. Recuperat de pe: en.wikipedia.org.



Nimeni nu a comentat acest articol încă.