
Proprietăți, structură, utilizări, riscuri ale clorurii de mangan

clorură de mangan este o sare anorganică a cărei formulă chimică este MnClDouă. Este alcătuit din ioni MnDouă+ și Cl- într-un raport 1: 2; pentru fiecare cation MnDouă+ există de două ori mai mulți anioni Cl-.
Această sare poate forma diverși hidrați: MnClDouă2HDouăO, (dihidrat), MnCIDouă4HDouăO (tetrahidrat) și MnClDouă6HDouăO (hexahidrat) Cea mai comună formă de sare este tetrahidratul.

Proprietățile fizice ale clorurii de mangan, cum ar fi densitatea, punctul de topire și solubilitatea în apă, sunt influențate de gradul său de hidratare. De exemplu, punctul de topire al formei anhidre este mult mai mare decât cel al formei tetrahidrat..
Culoarea clorurii de mangan este roz pal (imaginea de sus). Paloarea este caracteristică sărurilor metalice de tranziție. Clorura de mangan este un acid Lewis slab.
Mineralul cunoscut sub numele de escacquita este forma natural anhidră a clorurii de mangan (II); ca kempita.
Clorura de mangan (II) este utilizată ca agent de aliere; catalizator în reacțiile de clorurare etc..
Indice articol
- 1 Proprietăți fizice
- 1.1 Aspect fizic
- 1.2 Masele molare
- 1.3 Puncte de topire
- 1.4 Punctul de fierbere
- 1.5 Densități
- 1.6 Solubilitatea în apă
- 1.7 Solubilitatea în solvenți organici
- 1.8 Descompunerea
- 1,9 pH
- 1.10 Stabilitate
- 2 Structura clorurii de mangan
- 2.1 Dihidrat
- 2.2 Anhidru
- 3 Nomenclatură
- 4 utilizări
- 4.1 Laborator
- 4.2 Industrie
- 4.3 Îngrășăminte și hrană pentru animale
- 5 Riscuri
- 6 Referințe
Proprietăți fizice
Aspectul fizic
- Forma anhidră: cristale cubice roz.
- Forma tetrahidrat: cristale monoclinice ușor deliquescente roșiatice.
Masele molare
- Anhidru: 125,838 g / mol.
- Dihidrat: 161.874 g / mol.
- Tetrahidrat: 197,91 g / mol.
Puncte de topire
- Anhidru: 654 ºC.
- Dihidrat: 135 ºC.
- Tetrahidrat: 58 ºC.
Punct de fierbere
Forma anhidră: 1.190 ºC.
Densități
- Anhidru: 2.977 g / cm3.
- Dihidrat: 2,27 g / cm3.
- Tetrahidrat: 2,01 g / cm3.
Solubilitatea apei
Formă anhidră: 63,4 g / 100 ml la 0 ° C; 73,9 g / 100 ml la 20 ° C; 88,5 g / 100 ml la 40 ° C; și 123,8 g / 100 ml la 100 ° C.
Solubilitate în solvenți organici
Solubil în piridină și etanol, insolubil în eter.
Descompunere
Dacă nu se iau măsurile de precauție adecvate, deshidratarea formelor hidratate la forma anhidră poate duce la deshidratare hidrolitică, cu producerea de clorură de hidrogen și oxiclorură de mangan..
pH
O soluție 0,2 M de clorură de mangan tetrahidrat în soluție apoasă are un pH de 5,5.
Stabilitate
Este stabil, dar sensibil la umiditate și incompatibil cu acizii puternici, metalele reactive și peroxidul de hidrogen.
Structura clorurii de mangan

Începând cu sarea tetrahidratată, cu cristale roz izbitoare, trebuie să fie alcătuită din complexe de coordonare (imaginea de sus). În ele, centrul metalic al MnDouă+ este înconjurat de un octaedru definit de patru molecule de HDouăO și doi anioni Cl-.
Rețineți că liganzii Cl- sunt în poziții cis; toate sunt echivalente în baza dreptunghiulară a octaedrului și nu contează dacă Cl este „mutat”- la oricare dintre celelalte trei poziții. Un alt posibil izomer pentru această moleculă de coordonate este în care atât Cl- sunt în poziții trans; adică în extreme diferite (una deasupra și cealaltă dedesubt).
Cele patru molecule de apă cu legăturile lor de hidrogen permit ca două sau mai multe octaedre să fie unite prin forțe dipol-dipol. Aceste punți sunt foarte direcționale și adaugă interacțiunile electrostatice dintre MnDouă+ și Cl-, stabiliți o structură ordonată caracteristică unui cristal.
Culoarea roz a MnClDouă4HDouăSau se datorează tranzițiilor electronice ale MnDouă+ și configurația sa d5. De asemenea, tulburările cauzate de apropierea moleculelor de apă și a clorurilor modifică cantitatea de energie necesară pentru a fi absorbită de astfel de electroni d5 pentru a călători niveluri mai ridicate de energie.
Dihidratează
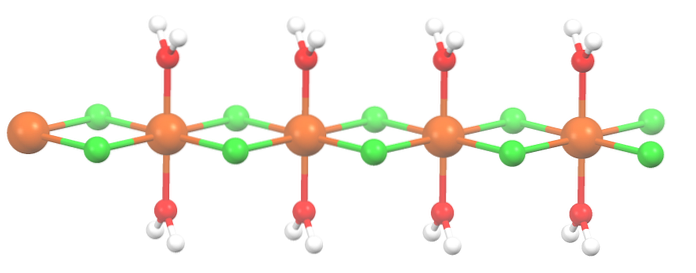
Sarea a fost deshidratată, iar formula sa este acum MnClDouă2HDouăO. Dar octaedrul de mai sus? Nimic, cu excepția faptului că cele două molecule de HDouăSau cele abandonate sunt înlocuite cu două Cl-.
La început, puteți da impresia greșită că sunt patru Cl- pentru fiecare MnDouă+; cu toate acestea, jumătatea octaedrului (axial) este de fapt unitatea care se repetă a cristalului.
Astfel, este adevărat că există un MnDouă+ coordonate la două Cl- și două molecule de apă în poziții trans. Dar pentru ca această unitate să interacționeze cu alta are nevoie de două poduri Cl, care, la rândul lor, să permită finalizarea octaedrului de coordonare pentru mangan..
Pe lângă punțile Cl, moleculele de apă colaborează și cu legăturile lor de hidrogen, astfel încât acest lanț MnClDouă2HDouăSau nu dezarmați.
Anhidru
În cele din urmă, clorura de magneziu a terminat de pierdut toată apa conținută în cristalele sale; acum avem sarea anhidră, MnClDouă. Fără moleculele de apă, cristalele își pierd în mod vizibil intensitatea culorii lor roz. Octaedrul, ca și pentru hidrați, rămâne neschimbat prin însăși natura manganului.
Fără molecule de apă, MnDouă+ se termină înconjurat de un octaedru compus doar din Cl-. Această legătură de coordonare are un caracter covalent și ionic; din acest motiv se referă de obicei la structura MnClDouă ca un cristal polimeric. În el există straturi alternative de Mn și Cl.
Nomenclatură
Manganul are multe stări de oxidare posibile. Din această cauză, nomenclatura tradițională pentru MnClDouă nu este clarificat.
Pe de altă parte, clorura de mangan corespunde denumirii sale mai bine cunoscute, la care ar fi necesar să adăugați „(II)” pentru a fi de acord cu nomenclatura stoc: clorura de mangan (II). Și, de asemenea, există nomenclatura sistematică: diclorură de mangan.
Aplicații
Laborator
Clorura de mangan servește drept catalizator pentru clorarea compușilor organici.
Industrie
Clorura de mangan este utilizată ca materie primă pentru fabricarea anti-nockerurilor pentru benzină; material de sudură pentru metale neferoase; intermediar în fabricarea pigmenților; și uscător de ulei de in.
Este utilizat în industria textilă pentru tipărire și vopsire; în producția diferitelor săruri de mangan, inclusiv metilciclopentadienilmanganez tricarbonil utilizat ca colorant pentru cărămidă; și în producția de celule electrice uscate.
Clorura de mangan este utilizată ca agent de aliere și se adaugă la magneziu topit pentru a produce aliaje de mangan-magneziu; ca intermediar în prepararea agenților de uscare pentru vopsea și lac; și ca componentă a dezinfectanților.
Este, de asemenea, utilizat în purificarea magneziului.
Îngrășăminte și hrană pentru animale
Clorura de mangan este utilizată ca sursă de mangan, element care, deși nu este un element nutrițional primar pentru plante precum azotul, fosforul și potasiul, este utilizat în numeroase reacții biochimice tipice acestor ființe vii.
De asemenea, este adăugat la hrana animalelor de reproducție pentru a furniza mangan, un oligoelement esențial pentru creșterea animalelor..
Clorura de mangan este o componentă dietetică care furnizează mangan, un element care este implicat în multe procese necesare vieții, inclusiv: sinteza acizilor grași și a hormonilor sexuali; asimilarea vitaminei E; producerea cartilajului; etc..
Riscuri
Poate provoca roșeață, iritații și dermatite la contactul cu pielea. Clorura de mangan provoacă ochi roșii, dureroși și apoși.
Când este inhalată, sarea provoacă tuse, dureri în gât și dificultăți de respirație. Pe de altă parte, ingestia poate provoca vărsături, greață și diaree..
Inhalarea excesivă cronică a acestei sări poate duce la inflamații pulmonare și la boli reactive ale căilor respiratorii..
Ingerarea excesivă a acestuia poate provoca tulburări psihice, deshidratare, hipotensiune arterială, insuficiență hepatică și renală, eșec al sistemului multiorgan și moarte..
Neurotoxicitatea este manifestarea inițială a acțiunii nedorite a manganului și poate prezenta dureri de cap, amețeli, pierderi de memorie, hiperreflexie și tremor ușor..
Toxicitatea severă se manifestă prin simptome și semne similare cu cele observate în boala Parkinson.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Clorură de mangan (II). Recuperat de pe: en.wikipedia.org
- Nanomateriale Sky Spring. (2016). Pulbere de clorură de mangan. Recuperat de pe: ssnano.com
- Carte chimică. (2017). Clorură de mangan. Recuperat de pe: chemicalbook.com
- Rețea de date privind toxicologia. (s.f.). Clorură de mangan. Toxnet. Recuperat de la: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Clorură de mangan (II). doi.org/10.1002/047084289X.rm020
- Centrul Național pentru Informații despre Biotehnologie. (2019). Diclorură de mangan. Baza de date PubChem. CID = 24480. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minerale: mangan. Recuperat de pe: webconsultas.com



Nimeni nu a comentat acest articol încă.