
Caracteristici ale compușilor cuaternari, formare, exemple
compuși cuaternari Sunt toți aceia care au patru atomi sau ioni diferiți. Prin urmare, pot fi specii moleculare sau ionice. Diversitățile lor includ atât chimia organică, cât și cea anorganică, fiind un grup foarte voluminos; deși poate nu atât de mult în comparație cu compușii binari sau ternari.
Motivul pentru care numărul lor este mai mic se datorează faptului că cei patru atomi sau ioni trebuie să fie ținuți împreună de afinitățile lor chimice. Nu toate elementele sunt compatibile între ele și cu atât mai puțin atunci când este luat în considerare un cvartet; dintr-o dată o pereche dintre ele seamănă mai mult una cu cealaltă decât cu cealaltă pereche.
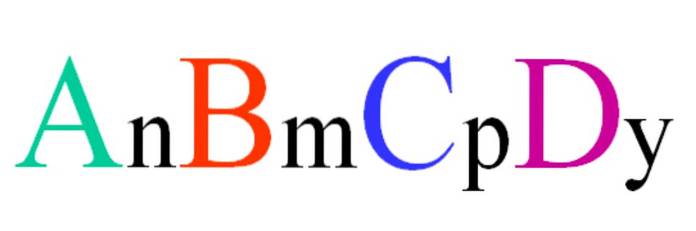
Luați în considerare un compus cuaternar cu formula aleatorie ABCD. Indicele n, m, p și y sunt coeficienții stoichiometrici, care la rândul lor indică ce proporție din fiecare atom există în raport cu ceilalți..
Astfel, formula AnBmCpDDa va fi valabil dacă respectă electroneutralitatea. Mai mult, un astfel de compus va fi posibil dacă cei patru atomi ai acestuia sunt suficient de legați între ei. Se va vedea că această formulă nu se aplică multor compuși, dar mai ales aliajelor sau mineralelor..
Indice articol
- 1 Caracteristicile compușilor cuaternari
- 1.1 Chimie
- 1.2 Fizic
- 2 Nomenclatură
- 2.1 Vânzări acide
- 2.2 Vânzări de bază
- 2.3 Săruri duble
- 2.4 Săruri hidratate
- 3 Instruire
- 4 Exemple
- 5 Referințe
Caracteristicile compușilor cuaternari
Chimic
Un compus cuaternar poate fi ionic sau covalent, prezentând caracteristicile așteptate pentru natura sa. Se așteaptă ca compușii ionici ABCD să fie solubili în apă, alcooli sau alți solvenți polari; ar trebui să aibă puncte de fierbere și de topire ridicate și să fie buni conductori de electricitate atunci când sunt topiți.
În ceea ce privește compușii ABCD covalenți, cei mai mulți constau din compuși organici azotati, oxigenati sau halogenati; adică formula sa ar deveni CnHmSAUpNDa sau CnHmSAUpXDa, unde X este un atom de halogen. Dintre aceste molecule ar fi logic să credem că sunt polare, având în vedere electronegativitățile ridicate ale O, N și X.
Un compus ABCD pur covalent poate avea multe posibilități de legare: A-B, B-C, D-A etc., în mod evident în funcție de afinitățile și capacitățile electronice ale atomilor. În timp ce într-un compus ABCD pur ionic, interacțiunile sale sunt electrostatice: A+B-C+D-, de exemplu.
În cazul unui aliaj, considerat mai mult un amestec solid decât un compus vorbind corect, ABCD constă din atomi neutri în stări de bază (în teorie).
Dintre restul, un compus ABCD poate fi neutru, acid sau bazic, în funcție de identitatea atomilor săi..
Fizic
Vorbind fizic, este probabil ca ABCD să nu devină gaz, deoarece patru atomi diferiți implică întotdeauna o masă moleculară mai mare sau o formulă. Dacă nu este un lichid cu un punct de fierbere ridicat, este de așteptat că este un solid, a cărui descompunere trebuie să genereze multe produse.
Din nou, culorile, mirosul, textura, cristalele etc. vor fi supuse modului în care A, B, C și D coexistă în compus și vor depinde de sinergia și structurile lor..
Nomenclatură
Până în prezent, problema compușilor cuaternari a fost abordată într-un mod global și imprecis. Lăsând deoparte chimia organică (amide, cloruri de benzii, săruri cuaternare de amoniu etc.), în chimia anorganică există exemple bine definite numite oxisaliți acizi și bazici..
Acizi oxizali
Oxizalții acizi sunt cei care derivă din neutralizarea parțială a unui oxo acid poliprotic. Astfel, unul sau mai mulți dintre hidrogenii săi sunt înlocuiți cu cationi metalici și cu cât are mai puțini hidrogeni rămași, cu atât va fi mai puțin acid..
De exemplu, din acid fosforic, H3PO4, Se pot obține până la două săruri acide de, să zicem, sodiu. Acestea sunt: NaHDouăPO4 (N / A+ înlocuiește un hidrogen echivalent cu H+) și NaDouăHPO4.
Conform nomenclaturii tradiționale, aceste săruri sunt denumite în același mod ca oxizalții (total deprotonate), dar cu cuvântul „acid” care precede numele metalului. Astfel, NaHDouăPO4 ar fi fosfat diacid de sodiu și NaDouăHPO4 fosfat acid de sodiu (pentru că mai are un H).
Pe de altă parte, nomenclatura stocului preferă să utilizeze cuvântul „hidrogen” decât „acid”. NaHDouăPO4 ar deveni apoi dihidrogen fosfat de sodiu și NaDouăHPO4 hidrogen fosfat de sodiu. Rețineți că aceste săruri au patru atomi: Na, H, P și O.
Vânzări de bază
Oxalzii de bază sunt cei care conțin anionul OH în compoziția lor-. De exemplu, luați în considerare sarea CaNO3OH (CaDouă+ NU3- Oh-). Pentru a-l numi, ar fi suficient să precede cuvântul „de bază” față de numele metalului. Astfel, numele său ar fi: azotat de calciu bazic. Și ce zici de CuIO3OH? Numele său ar fi: iodat de bază cupric (CuDouă+ IO3- Oh-).
Conform nomenclaturii stocului, cuvântul „de bază” este înlocuit cu hidroxid, urmat de utilizarea unei cratime înaintea numelui oxoanionului.
Repetând exemplele anterioare, numele lor ar fi pentru fiecare: hidroxid de calciu-azotat și hidroxid de cupru (II) -iodat; amintindu-ne că valența metalului trebuie indicată între paranteze și cu cifre romane.
Săruri duble
În sărurile duble există doi cationi diferiți care interacționează cu același tip de anion. Să presupunem sare dublă: Cu3Credință (PO4)3 (CuDouă+ Credinţă3+ PO43-). Este un fosfat de fier și cupru, dar cel mai potrivit nume pentru a face referire la acesta este: fosfat triplu de cupru (II) și fier (III).
Săruri hidratate
Acestea sunt hidrați și singura diferență este că numărul de apă de formulat este specificat la sfârșitul numelor lor. De exemplu, MnClDouă este clorura de mangan (II).
Hidratul său, MnClDouă4HDouăSau se numește clorură de mangan (II) tetrahidrat. Rețineți că există patru atomi diferiți: Mn, Cl, H și O.
O celebră sare dublă hidratată este Mohr's, Fe (NH4)Două(SW4)Două6HDouăO. Numele său este: sulfat de fier dublu (II) și hexahidrat de amoniu.
Instruire
Din nou, concentrându-ne asupra compușilor cuaternari anorganici, se pare că acestea sunt în mare parte produsul neutralizărilor parțiale. Dacă acestea apar în prezența mai multor oxizi metalici, este posibil să apară săruri duble; iar dacă mediul este foarte de bază, oxisalții de bază vor precipita.
Și dacă, pe de altă parte, moleculele de apă au o afinitate pentru metal, se vor coordona direct cu acesta sau cu ionii care îl înconjoară, formând hidrații.
Pe partea de aliaj, patru metale sau metaloizi diferiți trebuie sudate pentru a produce condensatori, semiconductori sau tranzistori..
Exemple
În cele din urmă, o listă cu diferite exemple de compuși cuaternari este prezentată mai jos. Cititorul îl poate folosi pentru a-și testa cunoștințele despre nomenclatură:
- PbCO3(OH)Două
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- CuDouă(OH)DouăSW3
- LiDouăKAsO4
- CURS45HDouăSAU
- AgAu (SO4)Două
- Caz42HDouăSAU
- FeCl36HDouăSAU
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Nomenclatură și formulare anorganică. [PDF]. Recuperat de la: recursostic.educacion.es
- Erika Thalîa Bine. (2019). Săruri duble. Academie. Recuperat de pe: academia.edu
- Wikipedia. (2019). Cation cuaternar de amoniu. Recuperat de pe: en.wikipedia.org



Nimeni nu a comentat acest articol încă.