
Structura capsulei Bowman, histologie, funcții

Capsula lui Bowman reprezintă segmentul inițial al componentei tubulare a nefronului, unitatea anatomico-funcțională a rinichiului în care se desfășoară procesele de producere a urinei și cu care rinichiul contribuie la conservarea homeostaziei organismului.
A fost numit în cinstea oftalmologului și anatomistului englez Sir William Bowman, care a descoperit existența acestuia și a publicat descrierea histologică pentru prima dată în 1842..
Există o oarecare confuzie în literatură cu privire la nomenclatura segmentelor inițiale ale nefronului, inclusiv capsula lui Bowman. Uneori este descris ca o parte diferită a glomerulului și constituind cu acesta corpusculul renal, în timp ce pentru altele funcționează ca un membru al glomerulului.
Indiferent dacă în descrierile anatomice capsula face parte sau face parte din glomerul, faptul este că ambele elemente sunt atât de strâns asociate în structura și funcția lor, încât termenul de glomerul trezește la cei care se gândesc la asta ideea unui sferă mică cu vasele sale..
Altfel, capsula ar fi pur și simplu un recipient în care fluidul filtrat este turnat în glomerul, dar nu ar avea nici o parte în procesul de filtrare glomerulară în sine. Ceea ce nu este cazul, deoarece, așa cum se va vedea, face parte din acel proces la care contribuie în mod special.
Indice articol
- 1 Structură și histologie
- 2 Funcții
- 3 Determinanți ai mărimii filtrării glomerulare
- 3.1 Coeficientul de filtrare (Kf)
- 3.2 Presiunea efectivă de filtrare (Peff)
- 4 Indicele de filtrare (IF) al substanțelor prezente în plasmă
- 5 Referințe
Structura și histologia
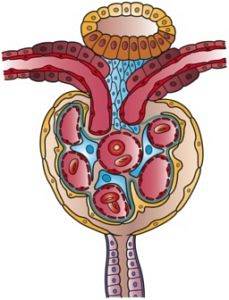
Capsula lui Bowman este ca o mică sferă al cărei perete se invaginează în sectorul vascular. În această invaginație, capsula este pătrunsă de bila capilarelor, care își are originea în arteriola aferentă și furnizează sânge glomerulului, de unde iese și arteriola eferentă, care extrage sângele din glomerul..
Capătul opus al capsulei, numit pol urinar, apare ca și cum peretele sferei ar avea o gaură la care este conectat capătul primului segment care inițiază funcția tubulară în sine, adică tubulul contur proximal..
Acest perete exterior al capsulei este un epiteliu plat și se numește epiteliul parietal al capsulei Bowman. Modificări ale structurii la tranziția la epiteliul tubular proximal la polul urinar și epiteliul visceral la polul vascular.
Epiteliul invaginat se numește visceral deoarece înconjoară capilarele glomerulare ca și cum ar fi un viscer. Este format din celule numite podocite care îmbrățișează, acoperindu-le, capilarele și au caracteristici foarte particulare.
Podocitele sunt organizate într-un singur strat, emitând extensii care se interdigitează cu extensiile podocitelor învecinate, lăsând spații între ele numite pori de fantă sau fantele de filtrare, care sunt soluții de continuitate pentru trecerea filtratului..
Podocitele și celulele endoteliale pe care le acoperă sintetizează o membrană bazală pe care se sprijină și care are și soluții de continuitate pentru trecerea apei și a substanțelor. Celulele endoteliale sunt fenestrate și permit, de asemenea, filtrarea.
Deci, aceste trei elemente: endoteliul capilar, membrana bazală și epiteliul visceral al capsulei Bowman, constituie împreună membrana sau bariera de filtrare..
Caracteristici
Capsula este asociată cu procesul de filtrare glomerulară. Pe de o parte, deoarece face parte din acoperirea epitelială a podocitelor care înconjoară capilarele glomerulare. De asemenea, contribuie la sinteza membranei bazale pe care se sprijină acest epiteliu și endoteliul capilar glomerular..
Aceste trei structuri: endoteliul capilar, membrana bazală și epiteliul visceral al capsulei Bowman, constituie așa-numita membrană de filtrare sau barieră și fiecare dintre ele are propriile sale caracteristici de permeabilitate care contribuie la selectivitatea globală a acelei bariere..
În plus, volumul de fluid care pătrunde în spațiul Bowman, împreună cu gradul de rigiditate care se opune peretelui exterior capsular, determină geneza unei presiuni intracapsulare care contribuie la modularea presiunii efective de filtrare și la antrenarea fluidului de-a lungul tubului asociat..
Determinanți ai mărimii filtrării glomerulare
O variabilă care colectează amploarea procesului de filtrare glomerulară este așa-numitul volum de filtrare glomerulară (GFR), care este volumul de fluid care este filtrat prin toți glomerulii într-o unitate de timp. Valoarea sa medie normală este de aproximativ 125 ml / min sau 180 L / zi.
Mărimea acestei variabile este determinată din punct de vedere fizic de doi factori, și anume așa-numitul coeficient de filtrare sau ultrafiltrare (Kf) și presiunea efectivă de filtrare (Peff). Adică: VFG = Kf x Peff (ecuația 1)
Coeficient de filtrare (Kf)
Coeficientul de filtrare (Kf) este produsul conductivității hidraulice (LP), care măsoară permeabilitatea la apă a unei membrane în ml / min pe unitate de suprafață și unitate de presiune de acționare, de ori suprafața (A) a membranei filtrante, adică Kf = LP x A (ecuația 2).
Mărimea coeficientului de filtrare indică volumul de lichid care este filtrat pe unitate de timp și pe unitate de presiune efectivă de acționare. Deși este foarte dificil de măsurat direct, acesta poate fi obținut din ecuația 1, împărțind VFG / Peff.
Kf în capilarele glomerulare este de 12,5 ml / min / mmHg per c / 100g de țesut, o valoare de aproximativ 400 de ori mai mare decât Kf din alte sisteme capilare din corp, unde pot fi filtrate aproximativ 0,01 ml / ml. Min / mm Hg la 100 g de țesut. Comparație care arată eficiența filtrării glomerulare.
Presiune efectivă de filtrare (Peff)
Presiunea efectivă de filtrare reprezintă rezultatul sumei algebrice a diferitelor forțe de presiune care favorizează sau se opun filtrării. Există un gradient de presiune hidrostatică (ΔP) și un gradient de presiune osmotică (oncotic, ΔП) determinat de prezența proteinelor în plasmă.
Gradientul de presiune hidrostatică este diferența de presiune dintre interiorul capilarului glomerular (PCG = 50 mm Hg) și spațiul capsulei Bowman (PCB = 12 mm Hg). După cum se poate observa, acest gradient este direcționat de la capilar la capsulă și promovează deplasarea lichidului în acea direcție..
Gradientul de presiune osmotică mută fluidul de la presiunea osmotică mai mică la mai mare. Doar particulele care nu filtrează au acest efect. Proteinele nu se filtrează. ПCB are 0 și în capilarul glomerular ПCG are 20 mm Hg. Acest gradient mută lichidul din capsulă în capilar.
Presiunea efectivă poate fi calculată prin aplicarea Peff = ΔP-ΔП; = (PCG-PCB) - (ПCG-ПCB); = (50-12) - (20-0); = 38-20 = 18 mm Hg. Astfel, există o presiune de filtrare eficientă sau netă de aproximativ 18 mm Hg care determină o GFR de aproximativ 125 ml / min..
Indicele de filtrare (IF) al substanțelor prezente în plasmă
Este un indicator al ușurinței (sau dificultății) cu care o substanță din plasmă poate traversa bariera de filtrare. Indicele se obține prin împărțirea concentrației substanței din filtrat (FX) la concentrația sa în plasmă (PX), adică: IFX = FX / PX.
Gama de valori IF este cuprinsă între maximum 1 pentru acele substanțe care filtrează liber și 0 pentru cele care nu filtrează deloc. Valorile intermediare sunt pentru particulele cu dificultăți intermediare. Cu cât valoarea este mai aproape de 1, cu atât filtrarea este mai bună. Mai aproape de 0, mai greu de filtrat.
Unul dintre factorii care determină IF este dimensiunea particulei. Cei cu diametre mai mici de 4 nm filtrează liber (IF = 1). Pe măsură ce dimensiunea crește mai aproape de cea a albuminei, IF scade. Particulele de dimensiunea albuminei sau mai mari au IF de 0.
Un alt factor care contribuie la determinarea IF este sarcinile electrice negative de pe suprafața moleculară. Proteinele sunt extrem de încărcate negativ, ceea ce se adaugă la dimensiunea lor pentru a face dificilă filtrarea. Motivul este că porii au sarcini negative care resping cele ale proteinelor.
Referințe
- Ganong WF: Funcție renală și micțiune, în Revizuirea fiziologiei medicale, Ediția a 25-a. New York, McGraw-Hill Education, 2016.
- Guyton AC, Sala JE: Sistemul urinar, în Manual de fiziologie medicală , Ediția a 13-a, AC Guyton, JE Hall (ed.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, în Physiologie des Menschen mit Pathophysiologie, Ed. 31, RF Schmidt și colab. (Eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funktion der nieren, in Fiziologie, Ediția a 6-a; R Klinke și colab. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl RAK și colab: Niere und capableitende Harnwege, in Klinische Pathophysiologie, Ed. A VIII-a, W Siegenthaler (ed.). Stuttgart, Georg Thieme Verlag, 2001.



Nimeni nu a comentat acest articol încă.