
Structura bisulfitului de sodiu (NaHSO3), proprietăți, utilizări, producție

bisulfit de sodiu este un solid anorganic format dintr-un ion de sodiu Na+ și un ion bisulfit HSO3-. Formula sa chimică este NaHSO3. Este un solid cristalin alb și datorită proprietăților sale antioxidante este utilizat pe scară largă ca conservant alimentar (de exemplu în unele gemuri).
NaHSO3 este un compus chimic reducător, care este opusul oxidantului și, din acest motiv, acționează ca antioxidant în multe dintre aplicațiile sale, cum ar fi produsele comestibile, deoarece previne deteriorarea lor.

Cu toate acestea, această utilizare a fost pusă la îndoială, deoarece au fost raportate cazuri de astm la oameni după ce au consumat alimente care conțin bisulfit de sodiu. Se spune chiar că distruge vitamina B1 în acestea.
Organizațiile internaționale de sănătate și-au limitat utilizarea la micro-cantități în alimente.
Cu toate acestea, bisulfitul de sodiu are multe alte utilizări, cum ar fi obținerea de iod, ca antiinfecțios, pentru albirea țesuturilor, pentru digestia lemnului în timpul preparării pastei de hârtie, ca dezinfectant pentru butoaie de bere și vin., Etc..
Indice articol
- 1 Structura chimică
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3,6 pH
- 3.7 Proprietăți chimice
- 3.8 Riscuri
- 4 Obținerea
- 5 utilizări
- 5.1 În industria celulozei și hârtiei
- 5.2 În industria alimentară
- 5.3 Controversă privind utilizarea sa în alimente
- 5.4 În aplicații agricole
- 5.5 În obținerea iodului
- 5.6 În industria mobilei și lemnului
- 5.7 În diverse aplicații
- 6 Referințe
Structura chimică
Bisulfitul de sodiu este alcătuit dintr-un cation Na de sodiu+ și un anion bisulfit HSO3-.
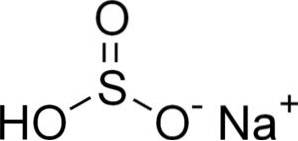
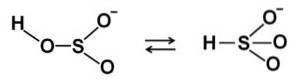
În soluții apoase bisulfitul formează 4 specii. În soluția diluată există un echilibru între structurile prezentate mai jos:
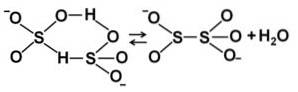
Când concentrația crește, două molecule de bisulfit interacționează între ele, formând ionul pirosulfit SDouăSAU5Două-:
Nomenclatură
-Bisulfit de sodiu
-Hidrogen sulfit de sodiu
-Hidrosulfit de sodiu.
Proprietăți
Starea fizică
Cristal alb solid.
Greutate moleculară
104,06 g / mol
Punct de topire
Se descompune.
Densitate
1,48 g / cm3 la 20 ° C.
Solubilitate
Solubil în apă: 29 g / 100 g apă.
pH
Soluțiile sale sunt acide, cu un pH cuprins între 2,5 și 5,5.
Proprietăți chimice
În soluție apoasă bisulfit de sodiu NaHSO3 se separă în ionii săi: cationul de sodiu Na+ și anionul bisulfit HSO3-.
Dacă bisulfitul de sodiu este expus la aer, pierde o cantitate de SODouă și se oxidează încet la sulfat de NaDouăSW4.
Dacă este încălzit până la descompunere, emite vapori de oxizi de sulf și monoxid de sodiu..
Este un agent reducător, care este opusul oxidantului. Și din acest motiv se poate comporta ca un antioxidant.
Are un ușor miros de sulf. Nu este inflamabil.
Riscuri
Bisulfit de sodiu NaHSO3 este un iritant puternic pentru piele și țesuturi. Praful irită ochii, nasul și gâtul. Dacă este înghițit, irită stomacul. Dozele mari pot provoca colici violente, diaree, depresie și moarte..
Nu este combustibil, dar dacă este încălzit, produce gaze iritante și toxice.
Obținerea
Se prepară prin saturarea unei soluții de carbonat de sodiu NaDouăCO3 cu dioxid de sulf SODouă și cristalizează în soluție.
Aplicații
În industria celulozei și hârtiei
NaHSO3 Se folosește la digestia lemnului, astfel încât să poată deveni ulterior hârtie. De asemenea, servește ca înălbitor pentru pulpă.
De asemenea, este utilizat pentru a elimina clorul atunci când pasta de hârtie a fost albită cu el..
În industria alimentară
Bisulfitul de sodiu, datorită proprietății sale reducătoare, acționează ca un antioxidant.
Este utilizat ca conservant într-un număr mare de alimente și băuturi, inclusiv vin și bere, pentru a preveni deteriorarea și pentru a îmbunătăți aroma.
Se folosește pentru albirea alimentelor, cum ar fi anumite amidonuri comestibile.
Reduce sau previne deteriorarea alimentelor, permite condiționarea aluatului folosit la produsele de patiserie și servește la înmuierea boabelor de porumb în timpul măcinării umede, printre alte utilizări.
Pe lângă controlul fermentației vinului și berii, acesta acționează ca un antiseptic în prepararea sa, deoarece servește ca sterilizator și fungicid în butoaie și cuve..

În fructele uscate se găsește în concentrații peste 100 ppm (ppm înseamnă „părți pe milion”), în multe alte alimente se găsește în concentrații între 10 și 100 ppm, cum ar fi cartofii congelați și uscați, murăturile, sosurile și gemurile.

Controversă privind utilizarea sa în alimente
A existat o oarecare îngrijorare cu privire la efectele toxice imediate și pe termen lung ale bisulfitului de sodiu în alimente. Există opinii divergente.
Există rapoarte de reacții adverse la pacienții cu astm, care este o boală respiratorie, după ingestia de alimente cu NaHSO3. Alte surse indică faptul că ionul bisulfit poate distruge vitamina B1 sau tiamina.

Cu toate acestea, anumiți cercetători din 1985 au descoperit că bisulfitul de sodiu servește pentru a proteja împotriva radiațiilor și a agenților chimici și inhibă sau previne transformarea celulelor în cancer. Dozele mici sunt cele mai bune.
Acest efect protector a fost explicat pe baza proprietăților sale reducătoare sau antioxidante și că în acest fel ar putea ataca radicalii liberi.
Pe de altă parte, Organizația Mondială a Sănătății sau OMS (pentru acronimul său în limba engleză Organizatia Mondiala a Sanatatii), recomandă ca un nivel acceptabil de aport zilnic aproximativ 0,7 mg / Kg din greutatea persoanei.
Asta înseamnă că se recomandă să nu depășiți suma respectivă..
Administrația SUA pentru Alimente și Medicamente sau USFDA. Administrația SUA pentru Alimente și Medicamente), a clasificat bisulfitul de sodiu drept „recunoscut în general ca fiind sigur”.
În aplicațiile agricole
NaHSO utilizat la concentrații scăzute3 servește ca regulator al creșterii plantelor, pentru a spori fotosinteza și a promova randamentul culturilor.
A fost testat în acest scop pe diferite tipuri de plante, cum ar fi plantele de căpșuni și ceai..

Este ingredientul activ al multor pesticide și biocide.
În mediile acvatice poate accelera, de asemenea, transformarea anumitor erbicide în produse mai puțin toxice prin eliminarea clorului..
În obținerea iodului
NaHSO3 este compusul reducător utilizat pentru a elibera iodul de iodatul de sodiu NaIO3. Aceasta este una dintre modalitățile de a obține iod din surse precum nitro din Chile sau unele ape saline.
După cristalizarea azotatului de sodiu din soluția brută de azotat de Chile, rămâne o soluție de NaIO3 care este tratat cu bisulfit de sodiu NaHSO3, generând iod gratuit.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + N / ADouăSW4 + EuDouă
În industria mobilei și lemnului
NaHSO3 A fost testat pentru a modifica proteinele din soia și a le îmbunătăți proprietățile de aderență cu lemnul pentru a lipi bucăți de lemn împreună pentru a pregăti, de exemplu, PAL, carton sau papier-mache, placaj etc. Toate acestea pentru mobilier sau scânduri, printre diverse aplicații.

Acest lucru se face pentru a înlocui adezivii tradiționali pe bază de formaldehidă, deoarece atât în procesul de fabricație, cât și în timpul utilizării lor, tind să elibereze formaldehidă în atmosferă, care este un compus toxic..
Bisulfitul de sodiu îmbunătățește conținutul de solide al adezivului proteic din soia și îi scade vâscozitatea, îmbunătățindu-i fluiditatea, astfel încât să pătrundă mai bine în porii lemnului, crescând coeziunea cu acesta și între bucăți..
Adezivul proteic de soia modificat NaHSO3 are o bună rezistență la apă și o stabilitate excelentă la depozitare datorită acțiunii antioxidante a bisulfitului de sodiu.
Acest lucru confirmă faptul că NaHSO a modificat adezivii de proteine din soia3 sunt comparabile cu adezivii pe bază de formaldehidă și pot fi utilizați în industria mobilierului și lemnului, fiind mai puțin poluanți.
În diverse aplicații
Are multiple utilizări, în general pe baza proprietăților sale de reducere (care este opusul oxidantului). Iată câteva aplicații.
-În fotografie.
-În bronzarea pielii, pentru a îndepărta părul de pe piei.
-Utilizări terapeutice: antiinfecțios. Este utilizat ca antioxidant în unele picături pentru ochi.
-La extragerea gazelor naturale prin fracturare hidraulică.
-În colorarea fibrelor este utilizat pentru prepararea căzilor calde sau reci, pentru a solubiliza anumiți coloranți sau coloranți.
-Ca reductor în rufe sau înălbire, pentru a albi lâna, mătasea și fibrele vegetale.
-În laboratoarele de chimie pentru îndepărtarea petelor de permanganat de pe piele și îmbrăcăminte. În laboratoarele de biochimie ca conservant pentru lichide sau soluții care se pot deteriora în timp. Ca reactiv chimic.
-Pentru coagularea latexului de cauciuc.
-În industria cosmetică ca antioxidant.
-Dezinfectant și înălbitor.
-În tratarea apelor uzate pentru eliminarea clorului utilizat în etapa finală de dezinfecție și pentru deversarea apei deja tratate în mediu.

Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Bisulfit de sodiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Qi, G. și colab. (2013). Aderența și proprietățile fizico-chimice ale proteinelor din soia modificate de bisulfit de sodiu. J Am Oil Chem Soc (2013) 90: 1917-1926. Recuperat de la aocs.onlinelibrary.wiley.com.
- Borek, C. și colab. (1985). Bisulfitul de sodiu protejează împotriva transformării radiogene și induse chimic în celulele C3H / 10T-1/2 de șoarece și embrion de hamster. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Recuperat de la journals.sagepub.com.
- Friedler, E. și colab. (2015). O abordare continuă de monitorizare activă pentru a identifica conexiunile încrucișate între apa potabilă și sistemele de distribuție a efluenților. Environ Monit Assess (2015) 187: 131. Recuperat de pe link.springer.com.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Programul Sunnyvale Cleanwater. (2019). Planul general al instalației de control al poluării apei. Recuperat de la sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Aditivi în alimentele spaniole și legislația care reglementează autorizarea și utilizarea acestora. Cărți de viziune. Recuperat de pe books.google.co.ve.

Nimeni nu a comentat acest articol încă.