
Curba de încălzire ce este, cum se face, exemple
A curba de încălzire este reprezentarea grafică a modului în care temperatura unui eșantion variază în funcție de timp, menținând presiunea constantă și adăugând căldură uniform, adică la o rată constantă.
Pentru a construi un grafic de acest tip, se iau perechi de valori ale temperaturii și timpului, care sunt ulterior reprezentate grafic plasând temperatura pe axa verticală (ordonată) și timpul pe axa orizontală (abscisa).

Apoi, cea mai potrivită curbă este adaptată acestor puncte experimentale și, în cele din urmă, se obține un grafic al temperaturii T în funcție de timpul t: T (t).
Indice articol
- 1 Care este curba de încălzire?
- 1.1 -Schimbarea stării într-o substanță
- 2 Cum faci o curbă de încălzire?
- 3 Exemple (apă, fier ...)
- 3.1 Topirea gheții
- 3.2 Transformarea apei în abur
- 4 Referințe
Care este curba de încălzire?
Pe măsură ce este încălzită, o substanță trece prin diferite stări succesive: de la a fi un solid poate deveni un vapor, trecând aproape întotdeauna prin starea lichidă. Aceste procese sunt numite schimbări de stare, în care eșantionul își mărește energia internă în timp ce se adaugă căldură, după cum indică teoria cinetică moleculară..
Când adăugați căldură unui eșantion există două posibilități:
- Substanța își mărește temperatura, deoarece particulele sale sunt agitate cu o intensitate mai mare.
- Materialul suferă o schimbare de fază, în care temperatura rămâne constantă. Adăugarea căldurii are ca efect slăbirea într-o anumită măsură a forțelor care țin particulele împreună, astfel încât este ușor să treci de la gheață la apă lichidă, de exemplu.
Figura 2 prezintă cele patru stări ale materiei: solid, lichid, gaz și plasmă și numele proceselor care permit tranziția între ele. Săgețile indică direcția procesului.
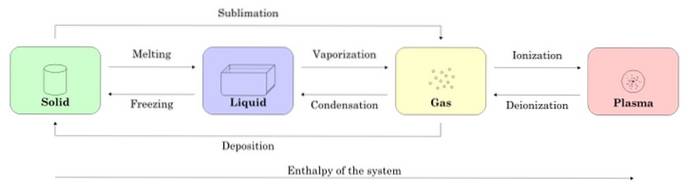
-Schimbări de stare într-o substanță
Începând cu o probă în stare solidă, atunci când se topește, aceasta trece în stare lichidă, când se vaporizează, se transformă în gaz și prin ionizare se transformă în plasmă.
Solidul poate fi convertit direct în gaz prin procesul cunoscut sub numele de sublimare. Există substanțe care se sublimează ușor la temperatura camerei. Cel mai cunoscut este CODouă sau gheață uscată, precum și naftalină și iod.
În timp ce eșantionul suferă o schimbare de stare, temperatura rămâne constantă până la atingerea noii stări. Aceasta înseamnă că, de exemplu, dacă aveți o porție de apă lichidă care a atins punctul de fierbere, temperatura acesteia rămâne constantă până când toată apa s-a transformat în abur..
Din acest motiv, se așteaptă ca curba de încălzire să fie compusă dintr-o combinație de secțiuni în creștere și secțiuni orizontale, unde acestea din urmă corespund schimbărilor de fază. Figura 3 prezintă una dintre aceste curbe pentru o anumită substanță.
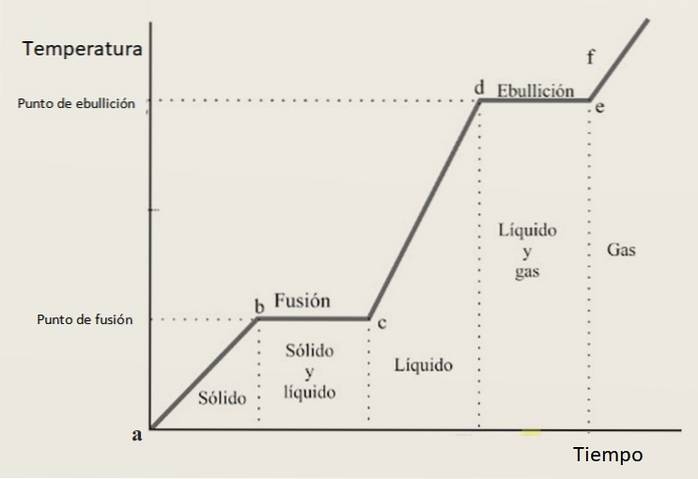
Interpretarea curbei de încălzire
În intervalele de creștere ab, CD Da ef substanța se găsește ca solid, lichid și respectiv gaz. În aceste regiuni energia cinetică crește și odată cu aceasta temperatura.
intre-timp in bc își schimbă starea de la solid la lichid, prin urmare cele două faze coexistă. Așa se întâmplă în secțiune din, în care proba se schimbă din lichid în gaz. Aici energia potențială se schimbă, iar temperatura rămâne constantă.
Este posibilă și procedura inversă, adică eșantionul poate fi răcit pentru a adopta succesiv alte stări. Într-un astfel de caz vorbim de curba de răcire.
Curbele de încălzire au același aspect general pentru toate substanțele, deși, desigur, nu sunt aceleași valori numerice. Unele substanțe durează mai mult decât altele pentru a schimba starea și se topesc și se vaporizează la temperaturi diferite..
Aceste puncte sunt cunoscute, respectiv, ca punct de topire și punct de fierbere și sunt caracteristici ale fiecărei substanțe..
De aceea, curbele de încălzire sunt foarte utile, deoarece indică valoarea numerică a acestor temperaturi pentru milioane de substanțe care există ca solide și lichide în intervalul de temperaturi considerate normale și la presiunea atmosferică..
Cum faci o curbă de încălzire?
În principiu, este foarte simplu: pur și simplu puneți o probă de substanță într-un recipient prevăzut cu un agitator, introduceți un termometru și încălziți uniform..
Simultan, la începerea procedurii, se activează un cronometru și se notează din când în când perechile corespunzătoare temperatură-timp..
Sursa de căldură poate fi un arzător de gaz, cu o rată de încălzire bună, sau o rezistență electrică care emite căldură atunci când este încălzită, care poate fi conectată la o sursă variabilă pentru a obține puteri diferite..
Pentru o mai mare precizie, există două tehnici utilizate pe scară largă în laboratorul de chimie:
- Analiza termică diferențială.
- Calorimetrie de scanare diferențială.
Ei compară diferența de temperatură dintre eșantionul studiat și un alt eșantion de referință cu o temperatură de topire ridicată, aproape întotdeauna un oxid de aluminiu. Cu aceste metode este ușor să găsiți punctele de topire și fierbere.
Exemple (apă, fier ...)
Luați în considerare curbele de încălzire pentru apă și fier prezentate în figură. Scara de timp nu este afișată, cu toate acestea este imediat să se distingă temperaturile de topire pentru ambele substanțe care corespund punctului B din fiecare grafic: pentru apă 0 ° C, pentru fier 1500 ° C.
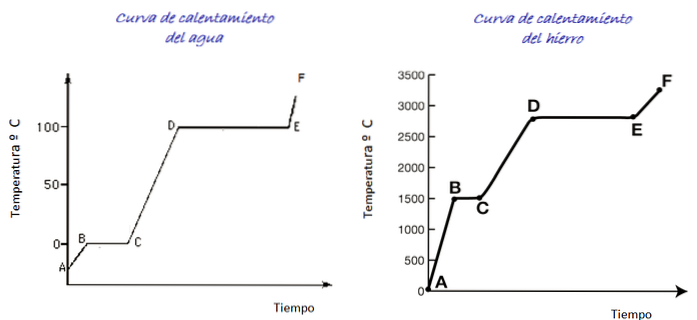
Apa este o substanță universală și gama de temperaturi necesare pentru a vedea schimbările de stare este ușor de realizat în laborator. Pentru fier sunt necesare temperaturi mult mai ridicate, dar așa cum s-a menționat mai sus, forma graficului nu se modifică substanțial..
Topirea gheții
La încălzirea eșantionului de gheață, conform graficului, suntem la punctul A, la o temperatură sub 0 ° C. Se observă că temperatura crește cu o rată constantă până la atingerea 0 ° C.
Moleculele de apă din gheață vibrează cu o amplitudine mai mare. Odată ce temperatura de topire (punctul B) este atinsă, moleculele se pot mișca deja una în fața celeilalte.
Energia care ajunge este investită în reducerea forței de atracție dintre molecule, astfel încât temperatura dintre B și C rămâne constantă până când toată gheața s-a topit..
Transformând apa în abur
Odată ce apa este complet în stare lichidă, vibrația moleculelor crește din nou și temperatura crește rapid între C și D până la punctul de fierbere de 100 ° C. Între D și E temperatura rămâne la acea valoare în timp ce energia care ajunge se asigură că toată apa din recipient se evaporă.
Dacă tot vaporii de apă pot fi conținuți într-un recipient, acesta poate continua încălzirea de la punctul E la punctul F, a cărui limită nu este prezentată în grafic..
O probă de fier poate suferi aceleași modificări. Cu toate acestea, având în vedere natura materialului, intervalele de temperatură sunt foarte diferite..
Referințe
- Atkins, P. Principiile chimiei: căile descoperirii. Editorial Médica Panamericana. 219-221.
- Chung, P. Curbele de încălzire. Recuperat de pe: chem.libretexts.org.
- Curbele de încălzire. Căldura de fuziune și vaporizare. Recuperat de pe: wikipremed.com.
- Hewitt, Paul. 2012. Științe fizice conceptuale. Al 5-lea. Ed. Pearson. 174-180.
- Universitatea din Valladolid. Licențiat în chimie, recuperat de la: lodging.uva.es.



Nimeni nu a comentat acest articol încă.