
Care este configurația electronică externă?

configurație electronică, Numită și structură electronică, este aranjamentul electronilor în niveluri de energie în jurul unui nucleu atomic. Conform vechiului model atomic Bohr, electronii ocupă diferite niveluri pe orbite în jurul nucleului, de la prima coajă cea mai apropiată de nucleu, K, până la a șaptea coajă, Q, care este cea mai îndepărtată de nucleu..
În ceea ce privește un model mecanic cuantic mai rafinat, cochiliile K-Q sunt împărțite într-un set de orbitali, fiecare dintre aceștia putând fi ocupat de cel mult o pereche de electroni..
În mod obișnuit, configurația electronică este utilizată pentru a descrie orbitalii unui atom în starea sa de bază, dar poate fi utilizată și pentru a reprezenta un atom care s-a ionizat într-un cation sau anion, compensând pierderea sau câștigul de electroni în orbitalii lor respectivi. ..
Multe dintre proprietățile fizice și chimice ale elementelor pot fi corelate cu configurațiile lor electronice unice. Electronii de valență, electronii din învelișul exterior, sunt factorul determinant pentru chimia unică a elementului..
Bazele configurațiilor electronice
Înainte de a atribui electronii unui atom orbitalilor, ar trebui să vă familiarizați cu elementele de bază ale configurațiilor electronice. Fiecare element din tabelul periodic este format din atomi, care sunt alcătuite din protoni, neutroni și electroni..
Electronii prezintă o sarcină negativă și se găsesc în jurul nucleului atomului în orbitalele electronului, definit ca volumul de spațiu în care electronul poate fi găsit în probabilitate de 95%..
Cele patru tipuri diferite de orbitali (s, p, d și f) au forme diferite, iar un orbital poate conține maximum doi electroni. Orbitalele p, d și f au subnivele diferite, deci pot conține mai mulți electroni.
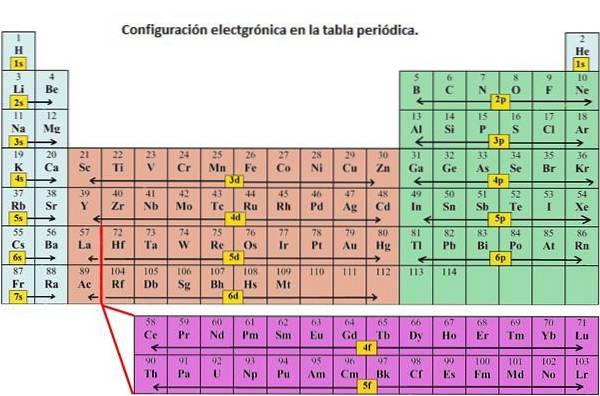
După cum sa indicat, configurația electronică a fiecărui element este unică pentru poziția sa în tabelul periodic. Nivelul de energie este determinat de perioadă, iar numărul de electroni este dat de numărul atomic al elementului.
Orbitalii la niveluri diferite de energie sunt similare, dar ocupă zone diferite în spațiu..
Orbitalul 1s și orbitalul 2s au caracteristicile unui orbital s (noduri radiale, probabilități de volum sferic, pot conține doar doi electroni etc.). Dar, deoarece sunt la niveluri diferite de energie, ei ocupă spații diferite în jurul nucleului. Fiecare orbital poate fi reprezentat prin blocuri specifice pe tabelul periodic..
Blocul s este regiunea metalelor alcaline, inclusiv heliul (grupurile 1 și 2), blocul d este metalele de tranziție (grupele 3-12), blocul p este elementele grupului principal al grupurilor 13-18, iar blocul f sunt seria lantanidă și actinidă.

Principiul Aufbau
Aufbau provine din cuvântul german „Aufbauen” care înseamnă „a construi”. În esență, scriind configurații de electroni construim orbitali de electroni pe măsură ce trecem de la un atom la altul..
Pe măsură ce scriem configurația electronică a unui atom, vom completa orbitalii în ordinea crescândă a numărului atomic.
Principiul Aufbau provine din principiul excluderii Pauli care spune că nu există doi fermioni (de exemplu, electroni) într-un atom. Pot avea același set de numere cuantice, deci trebuie să „stive” la niveluri de energie mai mari.
Cum se acumulează electronii este un subiect al configurațiilor electronice (principiul Aufbau, 2015).
Atomii stabili au la fel de mulți electroni ca și protonii din nucleu. Electronii se adună în jurul nucleului în orbitalele cuantice urmând patru reguli de bază numite principiul Aufbau..
- Nu există doi electroni în atom care să aibă aceleași patru numere cuantice n, l, m și s.
- Electronii vor ocupa mai întâi orbitalii cu cel mai scăzut nivel de energie.
- Electronii vor umple întotdeauna orbitalii cu același număr de centrifugare. Când orbitalii sunt plini, va începe.
- Electronii vor umple orbitalii cu suma numerelor cuantice n și l. Orbitalii cu valori egale de (n + l) vor fi umplute mai întâi cu cele n valori inferioare.
A doua și a patra regulă sunt practic aceleași. Un exemplu de regula patru ar fi orbitalii 2p și 3s.
Un orbital 2p este n = 2 și l = 2 și un orbital 3s este n = 3 și l = 1. (N + l) = 4 în ambele cazuri, dar orbitalul 2p are cea mai mică energie sau cea mai mică valoare n umpleți înainte de stratul 3s.
Din fericire, diagrama Moeller prezentată în Figura 2 poate fi utilizată pentru a realiza umplerea electronilor. Graficul este citit rulând diagonalele de la 1s.
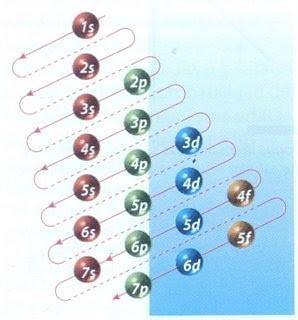
Figura 2 arată orbitalii atomici și săgețile urmează drumul înainte.
Acum, după ce se știe că ordinea orbitalilor este completată, singurul lucru rămas este să memoreze dimensiunea fiecărui orbital.
S orbitalii au o valoare posibilă de ml să țină 2 electroni
Orbitalii P au 3 valori posibile de ml să țină 6 electroni
Orbitalii D au 5 valori posibile de ml să țină 10 electroni
Orbitalii F au 7 valori posibile de ml să țină 14 electroni
Acesta este tot ceea ce este necesar pentru a determina configurația electronică a unui atom stabil al unui element..
De exemplu, luați elementul azot. Azotul are șapte protoni și, prin urmare, șapte electroni. Primul orbital care se umple este orbitalul 1s.
Un orbital s are doi electroni, deci au rămas cinci electroni. Următorul orbital este orbitalul 2s și conține următorii doi. Ultimii trei electroni vor merge pe orbitalul 2p care poate conține până la șase electroni (Helmenstine, 2017).
Importanța configurației electronice externe
Configurațiile electronice joacă un rol important în determinarea proprietăților atomilor.
Toți atomii aceluiași grup au aceeași configurație electronică externă, cu excepția numărului atomic n, motiv pentru care au proprietăți chimice similare.
Unii dintre factorii cheie care influențează proprietățile atomice includ dimensiunea celor mai mari orbitali ocupați, energia orbitalilor cu energie superioară, numărul de locuri libere orbitale și numărul de electroni din orbitalii cu energie superioară..
Cele mai multe proprietăți atomice pot fi legate de gradul de atracție dintre electronii cei mai exteriori către nucleu și de numărul de electroni din învelișul de electroni exterior, de numărul de electroni de valență.
Electronii învelișului exterior sunt cei care pot forma legături chimice covalente, sunt cei care au capacitatea de a se ioniza pentru a forma cationi sau anioni și sunt cei care dau starea de oxidare a elementelor chimice.
De asemenea, vor determina raza atomică. Pe măsură ce n devine mai mare, raza atomică crește. Când un atom pierde un electron, va exista o contracție a razei atomice datorită scăderii sarcinii negative în jurul nucleului..
Electronii învelișului exterior sunt cei care sunt luați în considerare de teoria legăturilor de valență, teoria câmpului cristalin și teoria orbitalelor moleculare pentru a obține proprietățile moleculelor și hibridizările legăturilor..
Referințe
- Principiul Aufbau. (2015, 3 iunie). Adus de la chem.libretexts: chem.libretexts.org.
- Știința Bozeman. (2013, epuizat 4). Configuratie electronica. Luat de pe youtube: youtube.com.
- Configurații electronice și proprietățile atomilor. (S.F.). Luat din oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7 septembrie). Configurare electronică. Luată din britannica: britannica.com.
- Faizi, S. (2016, 12 iulie). Configurări electronice. Luat din chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7 martie). Principiul Aufbau - Structură electronică și Principiul Aufbau. Luat de la thoughtco: thoughtco.com.
- Khan, S. (2014, 8 iunie). Electronii de valență și legătura. Luată din khanacademy: khanacademy.org.



Nimeni nu a comentat acest articol încă.