
Structura diclorometanului, proprietăți, utilizări, toxicitate
diclormetan, cunoscut și sub numele de clorură de metilen, este un compus organic a cărui formulă chimică este CHDouăClDouă. Mai exact, este o halogenură de alchil derivată din gaz metan. Spre deosebire de metan, acest compus este un lichid incolor, polar.
A fost sintetizat inițial în 1839 de chimistul și fizicianul francez Henri Victor Regnault (1810-1878), care a reușit să îl izoleze de un amestec de clor și clorometan expus la lumina soarelui..

Diclorometanul este produs industrial prin tratarea metanului sau clorometanului cu clor gazos la temperaturi ridicate (400-500 ° C). Împreună cu diclormetanul, cloroformul și tetraclorura de carbon sunt produse în acest proces, care sunt separate prin distilare..
Diclorometanul este utilizat ca solvent care permite sudarea materialelor plastice și degresarea metalelor. Este, de asemenea, utilizat în decofeinizarea cafelei și ceaiului, precum și ca extractor de hamei și diluant pentru aditivi de culoare și cerneluri pentru marcarea fructelor.
Diclorometanul este un compus toxic care poate provoca iritarea căilor nazale și a gâtului prin inhalare. Au fost raportate leziuni hepatice la lucrătorii expuși la concentrații mari de diclorometan. În plus, este un agent mutagen, fiind suspectat că este cancerigen.
Indice articol
- 1 Structură
- 2 Proprietăți
- 2.1 Aspect
- 2.2 Masa molară
- 2.3 Miros
- 2.4 Pragul mirosului
- 2.5 Densitate
- 2.6 Punct de topire
- 2.7 Punctul de fierbere
- 2.8 Solubilitatea în apă
- 2.9 Solubilitate în alți solvenți
- 2.10 Coeficientul de partiție octanol / apă
- 2.11 Presiunea vaporilor
- 2.12 Densitatea vaporilor
- 2.13 Indicele de refracție (πD)
- 2.14 Vâscozitatea
- 2.15 Punct de aprindere
- 2.16 Temperatura de autoinflamare
- 2.17 Stabilitate
- 2.18 Descompunerea
- 2.19 Coroziune
- 2.20 Căldura de vaporizare
- 2.21 Tensiunea superficială
- 2.22 Reactivitate
- 3 utilizări
- 3.1 Prelucrarea alimentelor
- 3.2 Industria farmaceutică
- 3.3 Fotografie
- 3.4 Industria electronică
- 3.5 Picturi
- 3.6 Transport
- 3.7 Alte utilizări
- 4 Toxicitate
- 4.1 Efecte acute
- 4.2 Efecte cronice
- 5 Referințe
Structura
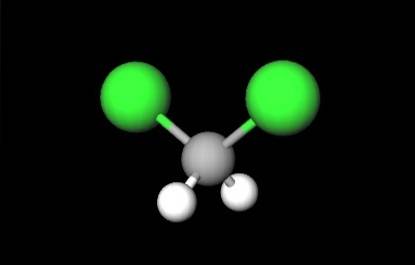
Prima imagine a arătat formula structurală a CHDouăClDouă, în care ies în evidență legăturile lor covalente C-H și C-Cl. Deasupra are și structura reprezentată de un model de sfere și bare. Observați cu ochiul liber că legăturile C-H (sfere albe) sunt scurte, în timp ce legăturile C-Cl (sfere verzi) sunt lungi.
Geometria CHDouăClDouă este tetraedric; dar distorsionat de atomii de clor mai voluminoși. Un capăt al tetraedrului este definit de cei doi atomi de clor, mai electronegativi decât cei ai hidrogenului și carbonului. Prin urmare, în molecula CHDouăClDouă se stabilește un moment dipol permanent (1.6D).
Acest lucru permite moleculelor de diclormetan să interacționeze între ele prin forțe dipol-dipol. De asemenea, aceste interacțiuni intermoleculare sunt responsabile de faptul că acest compus există ca lichid în ciuda masei sale moleculare scăzute; un lichid care, totuși, este destul de volatil.
Proprietăți
Aspect
Lichid incolor.
Masă molară
84,93 g / mol.
Miros
Dulce, asemănător cu cloroformul.
Pragul mirosului
205 - 307 ppm.
Densitate
1,3266 g / cm3 (20 ºC).
Punct de topire
- 97,6 ºC.
Punct de fierbere
39,6 ºC.
Solubilitatea apei
25,6 g / L la 15 ° C și 5,2 g / L la 60 ° C.
Diclorometanul este abia solubil în apă. În timp ce ambele molecule, CHDouăClDouă si HDouăSau sunt polare, interacțiunile lor sunt ineficiente, posibil datorită repulsiei dintre atomii de clor și oxigen.
Solubilitate în alți solvenți
Miscibil cu acetat de etil, alcool, hexan, benzen, tetraclorură de carbon, dietil eter, cloroform și dimetilformamidă.
Coeficientul de partiție octanol / apă
Jurnal P = 1,19.
Presiunea de vapori
57,3 kPa (25 ° C). Această presiune corespunde aproximativ 5,66 atm, reflectând o presiune de vapori ridicată..
Densitatea vaporilor
2,93 în raport cu aerul luat ca 1.
Indicele de refracție (πD)
1,4244 (20 ° C).
Viscozitate
0,413 cP (25 ° C).
punctul de aprindere
Diclorometanul nu este inflamabil, dar amestecat cu aerul formează vapori inflamabili peste 100 ° C..
temperatură de autoaprindere
556 ºC.
Stabilitate
Este stabil la temperatura ambiantă în absența umidității, având o stabilitate relativă în comparație cu congenerii săi: cloroform și tetraclorură de carbon..
Tinde să se încarce la temperaturi ridicate (300-450 ºC), când vaporii săi vin în contact cu cloruri de oțel și metal.
Descompunere
Se poate descompune la contactul cu suprafețe fierbinți sau cu o flacără, emițând vapori toxici și iritanți de fosgen și clorură de hidrogen..
Coroziune
Diclorometanul atacă unele forme de materiale plastice, cauciucuri și acoperiri.
Căldura de vaporizare
28,82 kJ / mol la 25 ° C.
Tensiune de suprafata
28,20 dynes / cm la 25 ° C.
Reactivitate
Diclorometanul reacționează puternic cu metalele active, cum ar fi potasiu, sodiu și litiu. Reacționează cu baze puternice, de exemplu, terț-butoxidul de potasiu. Este incompatibil cu substanțele caustice, oxidanți și metale chimic active.
În plus, reacționează cu oxigenul lichid din aliajele de sodiu și potasiu și de tetroxidul de azot. În contact cu apa poate coroda unele oțeluri inoxidabile, nichel, cupru, precum și fier.
Aplicații
Majoritatea utilizărilor și aplicațiilor diclorometanului se bazează pe proprietățile sale ca solvent. Datorită acestei caracteristici, diclormetanul este utilizat în industria alimentară, transporturilor, producției de medicamente etc..
Prelucrare alimentară
Diclorometanul este utilizat în decofeinizarea boabelor de cafea și a frunzelor de ceai. Este, de asemenea, utilizat pentru extragerea hameiului pentru bere, băuturi și alte arome pentru alimente, precum și pentru prelucrarea condimentelor..
Industria farmaceutica
Diclorometanul este utilizat pentru prepararea cefalosporinei și ampicilinei, pe lângă fabricarea de antibiotice, steroizi și vitamine.
Fotografie
Este, de asemenea, utilizat ca solvent în producția de triacetat de celuloză (CTA), utilizat la crearea filmelor de securitate.
Industria electronică
Este un compus ideal pentru producția de circuite imprimate, fiind utilizat pentru degresarea suprafeței de aluminiu înainte de a adăuga stratul de fotorezistent pe placă.
Vopsele
Diclorometanul este un solvent găsit în lacuri și separatoare de vopsea, utilizat pentru îndepărtarea lacurilor sau a acoperirilor de vopsea de pe diferite tipuri de suprafețe..
Transport
Se utilizează pentru degresarea pieselor și suprafețelor metalice prezente în echipamentele feroviare, precum și în componentele aeronavelor.
Alte utilizări
Este utilizat ca agent de propulsie spray (aerosoli) și ca agent de suflare pentru spuma poliuretanică. De asemenea, este utilizat ca fluid în unele tipuri de lumini de Crăciun.
Toxicitate
Efecte acute
Inhalarea diclorometanului poate provoca iritarea căilor respiratorii superioare, tuse, respirație șuierătoare sau dificultăți de respirație..
Poate provoca roșeața pielii și, dacă compusul rămâne pe el o perioadă lungă de timp, poate provoca arsuri chimice. În contact cu ochii, diclormetanul produce o iritație severă care se poate extinde până la arsură.
În plus, acționează ca o neurotoxină generatoare de tulburări vizuale, auditive și psihomotorii; dar aceste efecte sunt reversibile atunci când inhalarea diclorometanului este oprită.
Efecte cronice
Diclorometanul poate afecta sistemul nervos central, provocând dureri de cap, confuzie mentală, greață, vărsături și pierderi de memorie..
La animale produce efecte nocive asupra ficatului, rinichilor, sistemului nervos central și sistemului cardiovascular.
În ceea ce privește carcinogeneza, nu a fost raportată nicio creștere semnificativă a deceselor provocate de cancer la lucrătorii expuși la diclormetan. Cu toate acestea, studiile efectuate pe animale au arătat o creștere atribuită diclorometanului în incidența cancerului hepatic și pulmonar, precum și a tumorilor benigne ale glandelor mamare..
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. 5ta Ediție. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. (10a ediție.). Wiley plus.
- Centrul Național pentru Informații despre Biotehnologie. (2020). Diclorometan. Baza de date PubChem., CID = 6344. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Diclorometan. Recuperat de pe: en.wikipedia.org
- Brumer. (14 iulie 2018). Diclorometan. Recuperat de pe: brumer.com
- MSDS online. (2019). Diclorometan (clorură de metilen) Informații privind pericolele și siguranța. Recuperat de pe: msdsonline.com
- EPA. (2000). Clorură de metilen (diclorometan). [PDF]. Recuperat de la: epa.gov



Nimeni nu a comentat acest articol încă.