
Structura disulfurii de carbon (CS2), proprietăți, utilizări, riscuri
disulfură de carbon Este un compus format prin unirea unui atom de carbon (C) și a doi atomi de sulf (S). Formula sa chimică este CSDouă. Este un lichid incolor sau ușor galben, cu miros neplăcut datorită impurităților pe care le conține (compuși de sulf). Când este pur, mirosul său este moale și dulce, similar cu cloroformul sau eterul..
Acesta provine în mod natural din acțiunea soarelui asupra moleculelor organice găsite în apa de mare. În plus, este produs în apele mlaștinii și este, de asemenea, expulzat din vulcani împreună cu alte gaze.
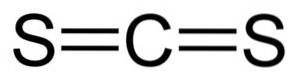
Disulfura de carbon este un lichid volatil și este, de asemenea, extrem de inflamabil, așa că ar trebui ținut departe de flăcări și scântei sau de dispozitive care le pot produce, chiar și becuri electrice..
Are capacitatea de a dizolva un număr mare de compuși, materiale și elemente, precum fosfor, sulf, seleniu, rășini, lacuri etc. Prin urmare, își găsește utilitatea ca solvent.
Este, de asemenea, un intermediar în diferite reacții chimice industriale, cum ar fi producerea de raion sau mătase artificială..
Trebuie manipulat cu precauție și cu instrumente de protecție, deoarece este foarte toxic și periculos.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punct de topire sau solidificare
- 3.4 Punctul de fierbere
- 3.5 Punct de aprindere
- 3.6 Temperatura de autoinflamare
- 3.7 Densitate
- 3.8 Presiunea vaporilor
- 3.9 Solubilitate
- 3.10 Proprietăți chimice
- 4 Obținerea
- 4.1 Prezența în natură
- 5 utilizări
- 5.1 În industria chimică
- 5.2 În producția de raion și celofan
- 5.3 În producția de tetraclorură de carbon
- 5.4 În diverse aplicații
- 5.5 Utilizări antice
- 6 Riscuri
- 7 Referințe
Structura
Disulfura de carbon are un atom de carbon și doi atomi de sulf pe ambele părți ale acestuia..
Legăturile dintre atomul de carbon și atomii de sulf sunt covalente și duble, prin urmare sunt foarte puternice. Molecula CSDouă are o structură liniară și simetrică.

Nomenclatură
- Disulfură de carbon
- Disulfură de carbon
- Anhidridă de ditiocarbon
Proprietăți
Starea fizică
Lichid incolor până la gălbui.
Greutate moleculară
76,15 g / mol
Punct de topire sau solidificare
-110,8 ° C
Punct de fierbere
46,0 ºC
Punct de aprindere
-30 ºC (metoda cupei închise).
temperatură de autoaprindere
90 ° C
Densitate
Lichid = 1,26 g / cm3 la 20 ° C.
Abur = 2,67 ori cel al aerului.
Vaporii săi sunt de peste două ori mai grei decât aerul, iar lichidul este mai greu decât apa.
Presiunea de vapori
279 mmHg la 25 ° C.
Aceasta este o presiune de vapori ridicată.
Solubilitate
Foarte ușor solubil în apă: 2,16 g / L la 25 ° C. Solubil în cloroform. Miscibil cu etanol, metanol, eter, benzen, cloroform și tetraclorură de carbon.
Proprietăți chimice
CSDouă se evaporă ușor la temperatura camerei, deoarece punctul său de fierbere este foarte scăzut și presiunea de vapori este foarte mare.
Disulfura de carbon este extrem de inflamabilă. Vaporii săi se aprind foarte ușor, chiar și cu căldura unui bec electric. Aceasta înseamnă că reacționează foarte repede cu oxigenul:
CSDouă + 3 ODouă → CODouă + 2 ASADouă
Faptul că are o presiune ridicată a vaporilor la temperatura camerei face periculos să fie lângă o flacără.
Când este încălzit până la descompunere, acesta poate exploda cu ușurință, emițând gaze toxice de oxid de sulf. Peste 90 ° C se aprinde spontan.
Se descompune atunci când este depozitat mult timp. Atacă cuprul și aliajele sale. De asemenea, reacționează cu unele materiale plastice, cauciucuri și acoperiri.
Reacționează în anumite condiții cu apa, formând sulfură de carbonil OCS, dioxid de carbon CODouă și hidrogen disulfură HDouăS:
CSDouă + HDouăO → OCS + HDouăS
CSDouă + 2 oreDouăO → CODouă + 2 oreDouăS
Cu alcooli (ROH) în mediu alcalin formează xantanți (RO-CS-SNa):
CSDouă + ROH + NaOH → HDouăO + RO-C (= S) -SNa
Obținerea
Disulfura de carbon este preparată comercial prin reacția sulfului cu carbonul. Procesul se desfășoară la temperaturi de 750-900 ° C.
C + 2 S → CSDouă
În loc de cărbune, pot fi folosiți, de asemenea, metan sau gaz natural și au fost utilizați chiar etan, propan și propilenă, caz în care reacția are loc la 400-700 ° C cu randament ridicat..
Poate fi preparat și prin reacția gazelor naturale cu hidrogen sulfurat HDouăS la temperatura foarte ridicata.
Prezență în natură
CSDouă este un produs natural prezent în atmosferă în cantități foarte mici (urme). Este produs fotochimic în apele de suprafață.
Acțiunea luminii solare asupra anumitor compuși prezenți în apa de mare precum cisteina (un aminoacid) duce la formarea disulfurii de carbon.

De asemenea, este eliberat natural în timpul erupțiilor vulcanice și se găsește în cantități mici peste mlaștini..
În mod normal, suntem expuși la respirație în proporții foarte mici și este prezent în unele alimente. Se găsește și în fumul de țigară.
În mediu este descompus de lumina soarelui. Pe sol se mișcă prin el. Unele microorganisme din sol îl descompun.
Aplicații
În industria chimică
Disulfura de carbon este un compus chimic important deoarece este utilizat pentru prepararea altor substanțe chimice. Poate acționa ca un intermediar chimic.
Este, de asemenea, utilizat ca solvent de proces, de exemplu, pentru a dizolva fosfor, sulf, seleniu, brom, iod, grăsimi, rășini, ceruri, lacuri și gume..
Permite fabricarea de produse farmaceutice și erbicide, printre altele.
În producția de raion și celofan
Cu CSDouă se prepară xantanți care sunt compuși folosiți la fabricarea raionului și celofanului.
Pentru obținerea mătăsii artificiale sau a raionului, se folosește celuloză, care este tratată cu alcalin și disulfură de carbon CSDouă și se transformă în xantat de celuloză, solubil în alcali. Această soluție este vâscoasă și, prin urmare, se numește „vâscoasă”.
Vâscoza este forțată prin găuri foarte mici într-o baie acidă. Aici xantatul de celuloză este transformat înapoi în celuloză care este insolubilă și se formează fire lungi și strălucitoare..
Firele sau filamentele pot fi filate într-un material cunoscut sub numele de raion.
(1) Celuloză + NaOH → Alcalino-celuloză
ROH + NaOH → RONa
(2) Alcali-celuloză + Disulfură de carbon → Xantat de celuloză
RONa + S = C = S → RO-C (= S) -SNa
(3) Xantat de celuloză + Acid → Celuloză (filamente)
RO-C (= S) -SNa + Acid → ROH

Dacă celuloza este precipitată prin trecerea xantatului printr-o fantă îngustă, celuloza este regenerată sub formă de foi subțiri care alcătuiesc celofanul. Acesta este înmuiat cu glicerol și este utilizat ca film protector pentru obiecte.

În producția de tetraclorură de carbon
Disulfura de carbon reacționează cu clorul ClDouă pentru a da tetraclorură de carbon CCl4, care este un solvent necombustibil important.
CSDouă + 3 ClDouă → CCl4 + SDouăClDouă
În diverse aplicații
Disulfura de carbon participă la vulcanizarea la rece a cauciucurilor, servește ca intermediar în fabricarea pesticidelor și este utilizată pentru a genera catalizatori în industria petrolieră și la fabricarea hârtiei..
Xantate preparate cu CSDouă sunt utilizate în flotația minerală.
Utilizări antice
CSDouă este o otravă pentru organismele vii. În trecut era folosit pentru a distruge dăunători precum șobolani, marmote și furnici, turnând lichidul în orice spațiu închis în care trăiau aceste animale (vizuini și furnici).
Atunci când sunt folosiți în acest scop, vaporii toxici densi au distrus orice organism viu care se afla în spațiul limitat..
De asemenea, a fost folosit ca antihelmintic pentru animale și pentru a elimina larvele de mufă din stomacul cailor..
În agricultură a fost folosit ca insecticid și nematicid, pentru fumigarea solului, pentru fumigarea pepinierelor, grânare, silozuri și fabrici de cereale. De asemenea, au fost pulverizate vagoane de cale ferată, nave și barje.

Toate aceste utilizări au fost interzise din cauza inflamabilității și toxicității ridicate a CSDouă.
Riscuri
CSDouă este foarte inflamabil. Multe dintre reacțiile lor pot provoca incendii sau explozii. Amestecurile vaporilor săi cu aerul sunt explozive. Când este aprins, produce gaze iritante sau toxice.
Disulfura de carbon nu trebuie turnată pe canalele de scurgere, deoarece un amestec de CS rămâne în tuburiDouă și aer care poate provoca o explozie dacă este aprins accidental.
Vaporii săi se aprind spontan la contactul cu scântei sau suprafețe fierbinți.
Disulfura de carbon irită grav ochii, pielea și membranele mucoase.
Dacă este inhalat sau ingerat, acesta afectează grav sistemul nervos central, sistemul cardiovascular, ochii, rinichii și ficatul. De asemenea, poate fi absorbit prin piele provocând leziuni.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2020). Disulfură de carbon. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Mopper, K. și Kieber, D.J. (2002). Fotochimia și ciclarea carbonului, a sulfului, a azotului și a fosforului. În Biogeochimia materiei organice dizolvate marine. Recuperat de la sciencedirect.com.
- Meyer, B. (1977). Utilizări industriale ale sulfului și compușilor săi. Disulfură de carbon. În sulf, energie și mediu. Recuperat de la sciencedirect.com.
- Pohanish, R.P. (2012). C. Disulfură de carbon. În Manualul Sittig de produse chimice și cancerigene toxice și periculoase (ediția a șasea). Recuperat de la sciencedirect.com.
- Morrison, R.T. și Boyd, R.N. (2002). Chimie organica. Ediția a 6-a. Prentice-Hall.
- Windholz, M. și colab. (editori) (1983). Indicele Merck. O enciclopedie a substanțelor chimice, a medicamentelor și a produselor biologice. Ediția a X-a. Merck & CO., Inc.


Nimeni nu a comentat acest articol încă.