
Structura, proprietățile, utilizările, riscurile dioxidului de sulf (SO2)

dioxid de sulf este un compus anorganic gazos format din sulf (S) și oxigen (O), formula sa chimică fiind SODouă. Este un gaz incolor cu miros iritant și sufocant. În plus, este solubil în apă, formând soluții acide. Vulcanii îl expulzează în atmosferă în timpul erupțiilor.
Face parte din ciclul biologic și geochimic al sulfului, dar este produs în cantități mari de anumite activități umane, cum ar fi rafinarea petrolului și arderea combustibililor fosili (cărbune sau motorină, de exemplu).

SODouă este un agent reducător care permite pastei de hârtie să rămână albă după albire cu alți compuși. De asemenea, servește la îndepărtarea urmelor de clor din apa care a fost tratată cu această substanță chimică.
Se folosește pentru conservarea unor tipuri de alimente, pentru dezinfectarea recipientelor în care se produce fermentarea sucului de struguri pentru a produce vin sau orz pentru a face bere..
De asemenea, este utilizat ca fungicid în agricultură, pentru obținerea acidului sulfuric, ca solvent și ca intermediar în reacțiile chimice..
SODouă prezent în atmosferă dăunează multor plante, în apă afectează peștii și este, de asemenea, unul dintre cei responsabili de „ploaia acidă” care corodează materialele create de oameni.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3,7 pH
- 3.8 Proprietăți chimice
- 3.9 Soluții apoase de SO2
- 3.10 Alte proprietăți
- 4 Obținerea
- 5 Prezență în natură
- 6 utilizări
- 6.1 În producția de acid sulfuric
- 6.2 În industria alimentară prelucrată
- 6.3 Ca solvent și reactiv
- 6.4 Ca agent de reducere
- 6.5 În diverse aplicații
- 7 Efectele SO2 endogen
- 8 Riscuri
- 8.1 Ecotoxicitate
- 8.2 Efectele ingerării acestuia cu alimente
- 9 Referințe
Structura
Molecula de dioxid de sulf este simetrică și formează un unghi. Unghiul se datorează SODouă Are o pereche de electroni solitari, adică electroni care nu formează o legătură cu niciun atom, dar sunt liberi.
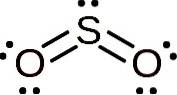
Nomenclatură
- Dioxid de sulf
- Anhidridă de sulf
- Oxid de sulf.
Proprietăți
Starea fizică
Gaz incolor.
Greutate moleculară
64,07 g / mol
Punct de topire
-75,5 ºC
Punct de fierbere
-10,05 ºC
Densitate
Gaz: 2,26 la 0 ° C (relativ la aer, adică densitatea aerului = 1). Aceasta înseamnă că este mai greu decât aerul..
Lichid: 1,4 până la -10 ° C (relativ la apă, adică densitatea apei = 1).
Solubilitate
Solubil în apă: 17,7% la 0 ° C; 11,9% la 15 ° C; 8,5% la 25 ° C; 6,4% la 35 ° C.
Solubil în etanol, dietil eter, acetonă și cloroform. Este mai puțin solubil în solvenți nepolari.
pH
Soluții apoase de SODouă sunt acide.
Proprietăți chimice
SODouă este un puternic agent reducător și oxidant. În prezența aerului și a unui catalizator, acesta se oxidează la SO3.
SWDouă + SAUDouă → SO3
Perechile izolate de electroni îl fac uneori să se comporte ca o bază Lewis, cu alte cuvinte, poate reacționa cu compuși în care există un atom care lipsește electroni.
Dacă sistemul de operareDouă este sub formă de gaz și uscat nu atacă aliajele de fier, oțel, cupru-nichel sau nichel-crom-fier. Cu toate acestea, dacă este în stare lichidă sau umedă, provoacă coroziunea acestor metale..
SODouă lichidul cu 0,2% apă sau mai mult produce coroziune puternică la fier, alamă și cupru. Este coroziv pentru aluminiu.
Când este lichid, poate ataca și unele materiale plastice, cauciucuri și acoperiri.
Soluții apoase de SODouă
SODouă este foarte solubil în apă. S-a considerat mult timp că în apă formează acid sulfuros HDouăSW3, dar existența acestui acid nu a fost dovedită.
În soluțiile de sistem de operareDouă în apă se produc următoarele echilibre:
SWDouă + HDouăO ⇔ ASADouă.HDouăSAU
SWDouă.HDouăO ⇔ HSO3- + H3SAU+
HSO3- + HDouăO ⇔ ASA3Două- + H3SAU+
Unde HSO3- este ionul bisulfit și SO3Două- este ionul sulfit. Ionul sulfit SO3Două- apare mai ales atunci când se adaugă un alcalin la soluția SODouă.
Soluții apoase de SODouă posedă proprietăți reducătoare, mai ales dacă sunt alcaline.
Alte proprietăți
- Este extrem de stabil la căldură, chiar și până la 2000 ° C.
- Nu este inflamabil.
Obținerea
SODouă Se obține prin arderea sulfului (S) în aer, deși se formează și cantități mici de SO3.
S + ODouă → SODouă
De asemenea, poate fi produs prin încălzirea diferitelor sulfuri din aer, arderea mineralelor de pirită și a mineralelor care conțin sulfuri, printre altele..
În cazul piritei de fier, atunci când se oxidează, se obțin oxid de fier (iii) și SO.Două:
4 FeSDouă + 11 ODouă → 2 FeDouăSAU3 + 8 ASADouă↑
Prezență în natură
SODouă Este eliberat în atmosferă de activitatea vulcanilor (9%), dar este cauzat și de alte activități naturale (15%) și de acțiunile umane (76%).
Erupțiile vulcanice explozive provoacă fluctuații anuale semnificative sau variații ale SODouă în atmosferă. Se estimează că 25% din SODouă emis de vulcani este spălat de ploaie înainte de a ajunge în stratosferă.
Sursele naturale sunt cele mai abundente și se datorează ciclului biologic al sulfului.
În zonele urbane și industriale predomină sursele umane. Principala activitate umană care o produce este arderea combustibililor fosili, cum ar fi cărbunele, benzina și motorina. Alte surse umane sunt rafinăriile de petrol, uzinele chimice și producția de gaze.

La mamifere, este generat endogen, adică în corpul animalelor și al oamenilor datorită metabolismului aminoacizilor (S) care conțin sulf, în special L-cisteina..
Aplicații
În producția de acid sulfuric
Una dintre cele mai importante aplicații ale sistemului de operareDouă este în obținerea acidului sulfuric HDouăSW4.
2 ASADouă + 2 oreDouăO + ODouă → 2 HDouăSW4
În industria alimentară procesată
Dioxidul de sulf este utilizat ca conservant și stabilizator alimentar, ca agent de control al umidității și ca modificator al gustului și texturii în anumite produse comestibile..
Este, de asemenea, utilizat pentru dezinfectarea echipamentelor care intră în contact cu alimente, echipamente de fermentare, precum cele din fabricile de bere și vinării, recipientele pentru alimente etc..
Permite conservarea fructelor și legumelor, le crește durata de valabilitate, previne pierderea culorii și a aromelor și ajută la păstrarea vitaminei C (acid ascorbic) și a carotenilor (precursorii vitaminei A).

Este folosit pentru conservarea vinului, deoarece distruge bacteriile, ciupercile și drojdiile nedorite. De asemenea, este folosit pentru sterilizarea și prevenirea formării nitrozaminelor în bere..

De asemenea, este utilizat pentru înmuierea boabelor de porumb, pentru albirea zahărului din sfeclă și ca antimicrobian în fabricarea siropului de porumb cu conținut ridicat de fructoză..
Ca solvent și reactiv
A fost utilizat pe scară largă ca solvent neapos. Deși nu este un solvent ionizant, este util ca solvent fără protoni pentru anumite aplicații analitice și reacții chimice..
Este utilizat ca solvent și reactiv în sinteza organică, intermediar în producerea altor compuși precum dioxid de clor, clorură de acetil și în sulfonarea uleiurilor..
Ca agent de reducere
Se folosește ca agent de reducere, deși nu este atât de puternic, iar în soluție alcalină se formează ionul sulfit, care este un agent de reducere mai energic..
În diverse aplicații
SODouă se mai folosește:
- În agricultură ca fungicid și conservant pentru struguri după recoltare.
- Pentru a produce hidrosulfiți.
- Pentru decolorarea pastei de lemn și a hârtiei, deoarece permite stabilizarea pulpei după decolorare cu peroxid de hidrogen HDouăSAUDouă; SODouă acționează prin distrugerea HDouăSAUDouă restul și astfel mențin strălucirea pulpei, deoarece HDouăSAUDouă poate provoca o inversare a luminozității.
- Pentru albirea fibrelor textile și a articolelor din răchită.
- Pentru a trata apa deoarece elimină clorul rezidual care rămâne după clorarea apei potabile, a apelor uzate sau a apei industriale.
- În rafinarea mineralelor și a metalelor, ca agent de reducere a fierului în timpul procesării mineralelor.
- În rafinarea petrolului pentru a prinde oxigenul și a întârzia coroziunea și ca solvent de extracție.
- Ca antioxidant.
- Ca neutralizator alcalin în fabricarea sticlei.
- În bateriile cu litiu ca agent oxidant.
Efectele sistemului de operareDouă endogen
Anumite studii au arătat că SODouă endogen sau produs de corpul însuși are un efect benefic asupra sistemului cardiovascular, inclusiv reglarea funcției inimii și relaxarea vaselor de sânge.
Când SO este produs în corpDouă devine derivații săi bisulfit HSO3- și sulfit SO3Două-, care exercită un efect vaso-relaxant asupra arterelor.
SODouă scade endogen hipertensiunea, previne dezvoltarea aterosclerozei și protejează inima de deteriorarea miocardului. De asemenea, are o acțiune antioxidantă, inhibă inflamația și apoptoza (moarte celulară programată).
Din aceste motive, se crede că ar putea fi o posibilă terapie nouă pentru bolile cardiovasculare..
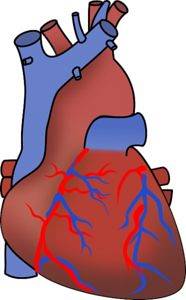
Riscuri
- Expunerea la SODouă gazos poate duce la arsuri la nivelul ochilor, pielii, gâtului și membranelor mucoase, leziuni ale bronhiilor și plămânilor.
- Unele studii raportează că prezintă un risc potențial de deteriorare a materialului genetic al celulelor mamifere și umane.
- Este coroziv. Nu este inflamabil.
Ecotoxicitate
Dioxidul de sulf este cel mai frecvent gaz poluant din atmosferă, în special în zonele urbane și industriale..
Prezența sa în atmosferă contribuie la așa-numita „ploaie acidă” care dăunează organismelor acvatice, peștilor, vegetației terestre și coroziunii materialelor de origine umană..

SODouă este toxic pentru pești. Plantele verzi sunt extrem de sensibile la SODouă atmosferic. Lucerna, bumbacul, orzul și grâul sunt deteriorate la un nivel scăzut al mediului, în timp ce cartofii, ceapa și porumbul sunt mult mai rezistente.
Efectele ingerării acestuia cu alimente
Deși este inofensiv pentru persoanele sănătoase, atunci când este utilizat în concentrațiile recomandate de agențiile de sănătate autorizate, SODouă poate induce astm la persoanele sensibile care îl ingerează cu alimente.
Alimentele care îl conțin de obicei sunt fructe uscate, băuturi răcoritoare artificiale și băuturi alcoolice.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Dioxid de sulf. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Huang, Y. și colab. (2016). Dioxid de sulf endogen: un nou membru al familiei de gasotransmițătoare din sistemul cardiovascular. Oxid Med Cell Longev. 2016; 2016: 8961951. Recuperat de la ncbi.nlm.nih.gov.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Windholz, M. și colab. (editori) (1983). Indicele Merck. O enciclopedie a substanțelor chimice, a medicamentelor și a produselor biologice. Ediția a X-a. Merck & CO., Inc.
- Pan, X. (2011). Oxizi de sulf: surse, expuneri și efecte asupra sănătății. Efectele oxizilor de sulf asupra sănătății. În Enciclopedia sănătății mediului. Recuperat de la sciencedirect.com.
- Tricker, R. și Tricker, S. (1999). Poluanți și contaminanți. Dioxid de sulf. În Cerințele de mediu pentru echipamente electromecanice și electronice. Recuperat de la sciencedirect.com.
- Bleam, W. (2017). Chimie acido-bazică. Oxizi de sulf. În chimia solului și a mediului (ediția a doua). Recuperat de la sciencedirect.com.
- Freedman, B.J. (1980). Dioxidul de sulf din alimente și băuturi: utilizarea sa ca conservant și efectul său asupra astmului. Br J Dis Chest. 1980; 14 (2): 128-34. Recuperat de la ncbi.nlm.nih.gov.
- Craig, K. (2018). O revizuire a chimiei, utilizării pesticidelor și a destinului de mediu al dioxidului de sulf, așa cum se utilizează în California. În Recenzii privind contaminarea mediului și toxicologie. Volumul 246. Recuperat de pe link.springer.com.

Nimeni nu a comentat acest articol încă.