
Caracteristici, structură și funcții ale domeniului SH2
Domeniul SH2 (Src Omologie 2) este un domeniu proteic extrem de conservat în evoluție și prezent în mai mult de 100 de proteine diferite, cea mai proeminentă fiind oncoproteina src, implicată în procesul de transducție a semnalului în celulă.
Funcția domeniului se leagă de secvențele de tirozină fosforilate pe proteinele țintă; Această uniune declanșează o serie de semnale care reglează expresia genelor. Acest domeniu a fost găsit și în enzima tirozin fosfatază.
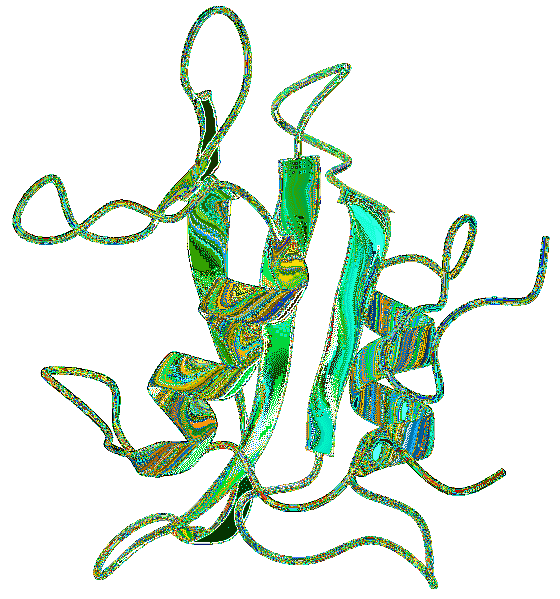
Domeniile SH2 se găsesc în general împreună cu alte domenii care au fost asociate cu căile de transducție a semnalului. Una dintre cele mai frecvente interacțiuni este conexiunea cu domeniul SH2 și SH3, care pare să fie implicat în reglarea interacțiunii cu secvențe bogate în prolină..
Proteinele pot conține un singur domeniu SH2 sau mai multe, cum ar fi proteina GAP și subunitatea p85 a fosfoinozitolului 3-kinazelor..
Domeniul SH2 a fost studiat pe larg de industria farmaceutică pentru a genera medicamente pentru combaterea bolilor precum cancerul, alergiile, bolile autoimune, astmul, SIDA, osteoporoza, printre altele..
Indice articol
- 1 Caracteristici
- 2 Structura
- 3 Funcții
- 4 Evoluție
- 5 Implicații clinice
- 5.1 Limfoproliferativ legat de X
- 5.2 Agamaglobulinemie legată de X
- 5.3 Sindromul Noonan
- 6 Referințe
Caracteristici
Domeniul SH2 constă din aproximativ 100 de aminoacizi conectați la domenii catalitice. Exemplul cel mai evident sunt enzimele tirozin kinazei, care sunt responsabile pentru catalizarea transferului unei grupări fosfat din ATP în reziduurile de aminoacizi ale tirozinei..
Mai mult, domeniile SH2 au fost raportate în domenii necatalitice, cum ar fi crk, grb2 / sem5 și nck..
Domeniile SH2 sunt prezente în eucariote superioare și s-a sugerat că apar și în drojdie. În ceea ce privește bacteriile, în Escherichia coli a fost raportat un modul care amintește domeniile SH2.
Proteina src este prima tirozin kinază descoperită, care atunci când este mutată este probabil implicată în reglarea activității kinazei și, de asemenea, în promovarea interacțiunilor acestor proteine cu alte componente din celulă..
După descoperirea domeniilor din proteina scr, domeniul SH2 a fost identificat într-un număr semnificativ de proteine foarte variate, incluzând protein tirozin kinaze și factori de transcripție..
Structura
Structura domeniului SH2 a fost dezvăluită prin utilizarea unor tehnici precum difracția de raze X, cristalografia și RMN (rezonanță magnetică nucleară), găsind modele comune în structura secundară a domeniilor SH2 studiate..
Domeniul SH2 are cinci motive extrem de conservate. Un domeniu generic este compus din foi de bază β cu porțiuni mici adiacente de foi β antiparalele, flancate de două elice α..
Reziduurile de aminoacizi de pe o parte a frunzei și în regiunea αA N-terminală sunt implicate în coordonarea legării peptidelor. Cu toate acestea, restul caracteristicilor proteinelor este destul de variabil în domeniile studiate..
În porțiunea terminală de carbon, un reziduu de izoleucină se găsește în a treia poziție și formează un buzunar hidrofob pe suprafața domeniului SH2..
O caracteristică importantă este existența a două regiuni, fiecare cu o anumită funcție. Zona dintre prima helix α și foaia β este situl de recunoaștere a fosfotirozinei.
La fel, regiunea dintre foaia β și helica α a carbonului terminal formează o regiune responsabilă de interacțiunea cu resturile de carbon terminale ale fosfotirozinei.
Caracteristici
Funcția domeniului SH2 este recunoașterea stării de fosforilare la reziduurile de aminoacizi din tirozină. Acest fenomen este crucial în transducția semnalului, atunci când o moleculă situată în afara celulei este recunoscută de un receptor de pe membrană și procesată în interiorul celulei..
Transducția semnalului este un eveniment de reglementare extrem de important, în care celula răspunde la schimbările din mediul său extracelular. Acest proces are loc datorită transducției semnalelor externe conținute în anumiți mesageri moleculari prin membrana sa..
Fosforilarea tirozinei duce la activarea secvențială a interacțiunilor proteină-proteină, ceea ce duce la o schimbare a expresiei genice sau la un răspuns celular modificat.
Proteinele care conțin domenii SH2 sunt implicate în căile de reglementare legate de procesele celulare esențiale, cum ar fi rearanjarea citoscheletală, homeostazia, răspunsurile imune și dezvoltarea..
Evoluţie
Prezența domeniului SH2 a fost raportată în organismul unicelular primitiv Monosiga brevicollis. Se crede că acest domeniu a evoluat ca o unitate de semnalizare invariantă cu apariția fosforilării tirozinei..
Se speculează că aranjamentul ancestral al domeniului a servit pentru a direcționa kinazele către substraturile lor. Astfel, odată cu creșterea complexității în organisme, domeniile SH2 au dobândit noi funcții pe parcursul evoluției, cum ar fi reglarea alosterică a domeniului catalitic al kinazelor..
Implicații clinice
Limfoproliferativ legat de X
Unele domenii SH2 mutante au fost identificate ca fiind cauzatoare de boli. Mutațiile din domeniul SH2 în SAP provoacă boli limfoproliferative legate de X, care determină o creștere ridicată a sensibilității la anumite virusuri și, astfel, proliferarea necontrolată a celulelor B..
Proliferarea are loc deoarece mutația domeniilor SH2 provoacă eșecuri în căile de semnalizare între celulele B și T, ducând la infecții virale și la creșterea necontrolată a celulelor B. Această boală are o rată ridicată a mortalității..
Agammaglobulinemia legată de X
În mod similar, mutațiile strutului din domeniul SH2 al protein kinazei Bruton sunt responsabile pentru o afecțiune numită agamaglobulinemie..
Această afecțiune este legată de X, caracterizată prin lipsa celulelor B și o scădere semnificativă a nivelurilor de imunoglobulină..
Sindromul Noonan
În cele din urmă, mutațiile din regiunea N-terminală a domeniului SH2 în proteina tirozin fosfatază 2 sunt cauza sindromului Noonan..
Această patologie se caracterizează în principal prin boli de inimă, statură scurtă datorată creșterii mai lente și anomalii faciale și scheletice. În plus, afecțiunea poate prezenta retard mental și psihomotor într-un sfert din cazurile studiate..
Referințe
- Berg, J. M., Stryer, L. și Tymoczko, J. L. (2007). Biochimie. Inversat.
- Filippakopoulos, P., Müller, S. și Knapp, S. (2009). Domenii SH2: modulatori ai activității tirozin kinazei nereceptoare. Opinia curentă în biologie structurală, 19(6), 643-649.
- Kurochkina, N. (Ed.). (2015). Domenii Sh: Structură, mecanisme și aplicații. Springer.
- Sawyer, T. K. (1998). Omologie SRC - 2 domenii: Structură, mecanisme și descoperirea medicamentelor. Știința peptidelor, 47(3), 243-261.
- Schlessinger, J. (1994). Proteine de semnalizare SH2 / SH3. Opinia actuală în genetică și dezvoltare, 4(1), 25-30.



Nimeni nu a comentat acest articol încă.