
Energia potențială de ionizare, metode de determinare

energie de ionizare se referă la cantitatea minimă de energie, exprimată în mod normal în unități de kilojuli pe mol (kJ / mol), care este necesară pentru a produce detașarea unui electron situat într-un atom de fază gazoasă care se află în starea sa de bază.
Starea gazoasă se referă la starea în care este liberă de influența pe care alți atomi o pot exercita asupra lor, precum și orice interacțiune intermoleculară este exclusă. Mărimea energiei de ionizare este un parametru pentru a descrie forța cu care un electron se leagă de atomul din care face parte..
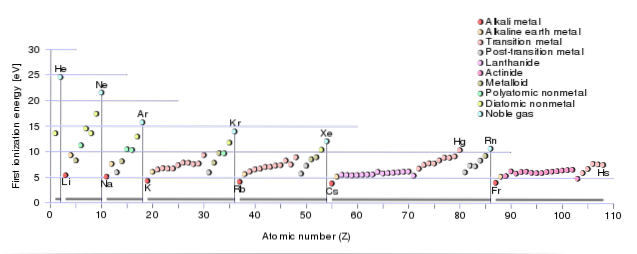
Cu alte cuvinte, cu cât este mai mare cantitatea de energie de ionizare necesară, cu atât va fi mai complicat să se detașeze electronul în cauză..
Indice articol
- 1 Potențial de ionizare
- 2 Metode de determinare a energiei de ionizare
- 3 Prima energie de ionizare
- 4 A doua energie de ionizare
- 5 Referințe
Potențial de ionizare
Potențialul de ionizare al unui atom sau al unei molecule este definit ca cantitatea minimă de energie care trebuie aplicată pentru a determina detașarea unui electron de învelișul exterior al atomului în starea sa de bază și cu o sarcină neutră; adică energia de ionizare.
Trebuie remarcat faptul că, atunci când vorbim de potențial de ionizare, se folosește un termen care a căzut în uz. Acest lucru se datorează faptului că anterior determinarea acestei proprietăți se baza pe utilizarea unui potențial electrostatic pentru eșantionul de interes..
Prin utilizarea acestui potențial electrostatic, s-au întâmplat două lucruri: ionizarea speciei chimice și accelerarea procesului de eliminare a electronului care trebuie eliminat..
Deci, atunci când începeți să utilizați tehnici spectroscopice pentru determinarea acestuia, termenul „potențial de ionizare” a fost înlocuit cu „energie de ionizare”.
De asemenea, se știe că proprietățile chimice ale atomilor sunt determinate de configurația electronilor prezenți la nivelul cel mai exterior al energiei în acești atomi. Deci, energia de ionizare a acestor specii este direct legată de stabilitatea electronilor lor de valență.
Metode de determinare a energiei de ionizare
După cum sa menționat anterior, metodele de determinare a energiei de ionizare sunt date în principal de procese de fotoemisiune, care se bazează pe determinarea energiei emise de electroni ca o consecință a aplicării efectului fotoelectric..
Deși s-ar putea spune că spectroscopia atomică este cea mai imediată metodă pentru determinarea energiei de ionizare a unei probe, există și spectroscopie fotoelectronică, în care sunt măsurate energiile cu care electronii sunt legați de atomi..
În acest sens, spectroscopia fotoelectronă ultravioletă - cunoscută și sub numele de UPS pentru acronimul său în engleză - este o tehnică care folosește excitația atomilor sau moleculelor prin aplicarea radiației ultraviolete..
Acest lucru se face pentru a analiza tranzițiile energetice ale electronilor cei mai exteriori din speciile chimice studiate și caracteristicile legăturilor pe care le formează..
Sunt de asemenea cunoscute spectroscopia fotoelectronică cu raze X și radiațiile ultraviolete extreme, care utilizează același principiu descris anterior cu diferențe în tipul de radiație care este afectat eșantionului, viteza cu care sunt expulzați electronii și rezoluția obținută.
Prima energie de ionizare
În cazul atomilor care au mai mult de un electron la nivelul cel mai exterior - adică așa-numiții atomi polielectronici - valoarea energiei necesare pentru a elimina primul electron din atomul care se află în starea sa de bază este dată de următoarea ecuație:
Energie + A (g) → A+(g) + e-
„A” simbolizează un atom al oricărui element, iar electronul detașat este reprezentat ca „e-”. Astfel se obține prima energie de ionizare, denumită „I1".
După cum se poate observa, are loc o reacție endotermă, deoarece energia este furnizată atomului pentru a obține un electron adăugat la cationul acelui element.
La fel, valoarea primei energii de ionizare a elementelor prezente în aceeași perioadă crește proporțional cu creșterea numărului lor atomic..
Aceasta înseamnă că scade de la dreapta la stânga într-o perioadă și de sus în jos în același grup al tabelului periodic..
În acest sens, gazele nobile au magnitudini mari în energiile lor de ionizare, în timp ce elementele aparținând metalelor alcaline și alcalino-pământoase au valori scăzute ale acestei energii..
A doua energie de ionizare
În același mod, atunci când un al doilea electron este îndepărtat din același atom, se obține a doua energie de ionizare, simbolizată ca „IDouă".
Energie + A+(g) → ADouă+(g) + e-
Aceeași schemă este urmată și pentru celelalte energii de ionizare la pornirea următoarelor electroni, știind că, urmată de detașarea electronului de un atom în starea sa de bază, efectul respingător existent între electronii rămași scade..
Deoarece proprietatea numită „sarcină nucleară” rămâne constantă, este necesară o cantitate mai mare de energie pentru a rupe un alt electron din specia ionică care are sarcina pozitivă. Deci, energiile de ionizare cresc, după cum se vede mai jos:
Eu1 < IDouă < I3 <… < In
În cele din urmă, pe lângă efectul sarcinii nucleare, energiile de ionizare sunt afectate de configurația electronică (numărul de electroni din carcasa de valență, tipul de orbital ocupat etc.) și de sarcina nucleară efectivă a electronului care trebuie aruncat..
Datorită acestui fenomen, majoritatea moleculelor de natură organică au valori ridicate ale energiei de ionizare..
Referințe
- Chang, R. (2007). Chimie, ediția a IX-a. Mexic: McGraw-Hill.
- Wikipedia. (s.f.). Energie de ionizare. Recuperat de pe en.wikipedia.org
- Hiperfizică. (s.f.). Energii de ionizare. Adus de la hyperphysics.phy-astr.gsu.edu
- Field, F. H. și Franklin, J. L. (2013). Fenomene de impact ale electronilor: și proprietățile ionilor gazoși. Recuperat de pe books.google.co.ve
- Carey, F. A. (2012). Chimie organică avansată: Partea A: Structură și mecanisme. Obținut din books.google.co.ve


Nimeni nu a comentat acest articol încă.