
Sigma Link Cum este format, caracteristici și exemple
link sigma (reprezentat ca σ) este o uniune de tip covalent, care se caracterizează prin împărțirea a doi electroni care are loc între o pereche de atomi pentru a forma legătura menționată. În plus, acesta este un fel de legătură simplă, în care ambii atomi sunt atașați de doi electroni pentru a forma o legătură simplă..
Când doi sau mai mulți atomi sunt combinați pentru a da naștere la noi compuși moleculari, aceștia sunt uniți prin intermediul a două tipuri de legături: ionice și covalente, a căror structură depinde de modul în care electronii sunt împărțiți între ambii atomi implicați în această cuplare..
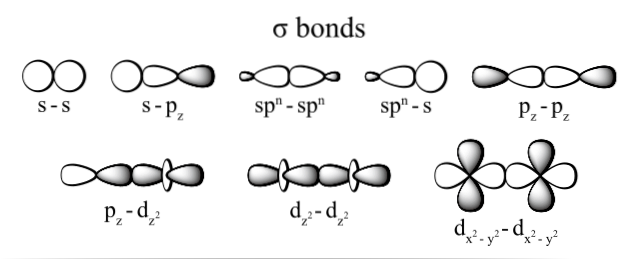
Conexiunea generată prin electroni se realizează grație suprapunerii orbitalilor care aparțin fiecărui atom (prin capetele lor), înțelegând ca orbitați spațiile în care este cel mai probabil să localizeze electronul în atom și care sunt definite de electron densitate.
Indice articol
- 1 Cum se formează?
- 1.1 Formarea legăturilor sigma la diferite specii chimice
- 2 caracteristici
- 3 Exemple
- 4 Referințe
Cum se formează?
De obicei, legătura simplă dintre doi atomi este cunoscută a fi echivalentă cu o legătură sigma simplă..
La fel, aceste legături își au originea datorită suprapunerii sau suprapunerii într-un mod frontal care are loc între capetele orbitalilor atomici ai doi atomi diferiți..
Acești atomi ale căror orbitali se suprapun trebuie să fie adiacenți unul cu celălalt, astfel încât electronii individuali aparținând fiecărui orbital atomic să se poată lega în mod eficient și să formeze legătura..
De aici și faptul că distribuția electronică care se manifestă sau locația densității electronilor din fiecare suprapunere are o simetrie cilindrică în jurul axei care apare între cele două specii atomice legate..
În acest caz, așa-numitul orbital sigma poate fi mai ușor exprimat în termeni de legături intramoleculare care se formează în cadrul moleculelor diatomice, menționând că există și mai multe tipuri de legături sigma..
Cele mai frecvent observate tipuri de legături sigma sunt: dzDouă+dzDouă, s + pz, pz+pz și s + s; unde indicele z reprezintă axa constituită din legătura formată și fiecare literă (s, p și d) corespunde unui orbital.
Formarea legăturilor sigma la diferite specii chimice
Când se vorbește despre orbitali moleculari, se face trimitere la regiunile care acumulează cea mai mare densitate a electronilor atunci când se formează o legătură de acest tip între diferite molecule, obținându-se prin combinația orbitalilor atomici..
Din punct de vedere al mecanicii cuantice, studiile au dedus că orbitalele de tip molecular care prezintă un comportament egal simetric sunt de fapt combinate în amestecuri (hibridizări).
Cu toate acestea, semnificația acestei combinații de orbitali este strâns legată de energiile relative manifestate de orbitalele de tip molecular care sunt simetric similare..
În cazul moleculelor organice, sunt frecvent observate specii ciclice formate din una sau mai multe structuri inelare, care sunt frecvent constituite dintr-un număr mare de legături de tip sigma împreună cu legături de tip pi (legături multiple)..
De fapt, folosind calcule matematice simple, este posibil să se determine numărul de legături sigma prezente într-o specie moleculară..
Există, de asemenea, cazuri de compuși de coordonare (cu metale de tranziție), în care legăturile multiple sunt combinate cu diferite clase de interacțiuni de legătură, precum și molecule formate din diferite tipuri de atomi (poliatomici).
Caracteristici
Legăturile Sigma au caracteristici unice care le diferențiază clar de alte tipuri de legături covalente (legătura pi), printre care se numără faptul că acest tip de legătură este cea mai puternică dintre legăturile chimice din clasa covalentă.
Acest lucru se datorează faptului că suprapunerea dintre orbitali are loc direct, coaxial (sau liniar) și frontal; adică se obține o suprapunere maximă între orbitali.
În plus, distribuția electronică la aceste joncțiuni este concentrată în principal între nucleele speciilor atomice care sunt combinate..
Această suprapunere a orbitalilor sigma are loc în trei moduri posibile: între o pereche de orbitali puri (s-s), între un orbital pur și un tip hibrid (s-sp) sau între o pereche de orbitali de tip hibrid (sp3- sp3).
Hibridizarea are loc datorită amestecului de orbitali de origine atomică din diferite clase, obținându-se astfel că orbitalul hibrid rezultat depinde de cantitatea fiecăruia dintre tipurile de orbitali de pornire puri (de exemplu, sp3 = un orbital pur s + trei orbitali de tip p pur).
În plus, legătura sigma poate exista independent, precum și admite mișcarea de rotație liberă între o pereche de atomi..
Exemple
Deoarece legătura covalentă este cel mai comun tip de legătură între atomi, legătura sigma se găsește într-un număr mare de specii chimice, așa cum se poate vedea mai jos.
În moleculele de gaz diatomic - cum ar fi hidrogenul (HDouă), oxigen (ODouă) și azot (NDouă) - pot apărea diferite tipuri de legături în funcție de hibridizarea atomilor.
În cazul hidrogenului, există o singură legătură sigma care unește ambii atomi (H-H), deoarece fiecare atom își contribuie singurul său electron.
Pe de altă parte, în oxigenul molecular ambii atomi sunt legați printr-o legătură dublă (O = O)-adică o legătură sigma- și o legătură pi, lăsând fiecare atom al său cu trei perechi de electroni rămași împerecheați.
În schimb, fiecare atom de azot are cinci electroni în nivelul său de energie exterior (coajă de valență), deci sunt uniți printr-o legătură triplă (N≡N), ceea ce implică prezența unei legături sigma și a două legături pi și a unei perechi de electroni împerecheați în fiecare atom.
În același mod, apare la compuși de tip ciclic cu legături simple sau multiple și la tot felul de molecule a căror structură este alcătuită din legături covalente..
Referințe
- Wikipedia. (s.f.). Sigma bond. Recuperat de pe en.wikipedia.org
- Chang, R. (2007). Chimie, ediția a IX-a. Mexic: McGraw-Hill.
- ThoughtCo. (s.f.). Definirea chimiei Sigma Bond. Recuperat de la thoughtco.com
- Britannica, E. (s.f.). Sigma bond. Adus de la britannica.com
- LibreTexte. (s.f.). Sigma și Pi Bonds. Recuperat de la chem.libretexts.org
- Srivastava, A. K. (2008). Chimia organică simplificată. Recuperat de pe books.google.co.ve



Nimeni nu a comentat acest articol încă.