
Structura și funcțiile fibronectinei

fibronectina Este o clasă de glicoproteină care aparține matricei extracelulare. Acest tip de proteine, în general, este responsabil pentru atașarea sau legarea membranei celulare de fibrele de colagen care se găsesc în exterior.
Numele „fibronectină” provine dintr-un cuvânt format din două cuvinte latine, primul fiind „fibră" ceea ce înseamnă fibră sau filament și, al doilea „Necter” ceea ce înseamnă să vă conectați, să legați, să lipiți sau să legați.
Fibronectina a fost vizualizată pentru prima dată în 1948 ca un contaminant al fibrinogenului preparat prin procesul de fracționare a etanolului rece al lui Cohn. Aceasta a fost identificată ca o glicoproteină plasmatică unică care posedă caracteristicile unei globuline insolubile la rece..
Această proteină are o greutate moleculară mare și a fost asociată cu o mare varietate de funcții în țesuturi. Acestea includ aderența dintre celulă și celulă, organizarea citoscheletului, transformarea oncogenă, printre altele..
Fibronectina este distribuită în multe locuri ale corpului prin forma sa solubilă în plasma sanguină, lichidul cefalorahidian, lichidul sinovial, lichidul amniotic, lichidul seminal, saliva și exudatele inflamatorii..
Cercetătorii au raportat că concentrațiile plasmatice de fibronectină cresc atunci când femeile gravide suferă de preeclampsie. Astfel, această creștere a concentrației de fibronectină a fost încorporată de specialiști pentru a diagnostica această afecțiune..
Indice articol
- 1 Structură
- 1.1 Domenii și proprietăți „multi-adeziune”
- 2 Funcții
- 3 Referințe
Structura
Fibronectinele sunt glicoproteine mari, care au o greutate moleculară de aproximativ 440 kDa. Acestea sunt compuse din aproximativ 2.300 de aminoacizi, care reprezintă 95% din proteine, deoarece celelalte 5% sunt carbohidrați.
Diferitele analize care au fost efectuate asupra secvenței genomice și transcriptomice (ARN mesager) a proteinei au indicat faptul că este compusă din trei blocuri de secvențe omoloage repetate, cu lungimi de 45, 60 și 90 de aminoacizi fiecare..
Cele trei tipuri de secvențe cuprind mai mult de 90% din structura totală a fibronectinelor. Secvențele omoloage de tip I și II sunt bucle legate între ele prin punți disulfurice. Aceste bucle conțin 45 și, respectiv, 60 de resturi de aminoacizi..
Secvențele omoloage de tip III corespund cu 90 de aminoacizi dispuși într-un mod liniar și fără punți disulfură interne. Cu toate acestea, unii dintre aminoacizii interni ai secvențelor omoloage de tip III au grupări sulfhidrice libere (R-S-H).
Cele trei secvențe omoloage se pliază și se organizează într-o matrice mai mult sau mai puțin liniară pentru a forma două „brațe dimerice” de subunități proteice aproape identice. Diferențele dintre cele două subunități apar din evenimente de maturare post-transcripțională.
Fibronectinele pot fi văzute în general în două moduri. O formă deschisă care se observă atunci când sunt depuse pe suprafața membranei și că sunt gata să se lege cu o altă componentă a exteriorului celulei. Această formă este văzută doar prin microscopie electronică..
Cealaltă formă poate fi văzută în soluții fiziologice. Capetele fiecărui braț sau extensie sunt pliate spre centrul proteinei, unindu-se prin capetele carboxil ale situsurilor de legare a colagenului. În această formă proteina are un aspect globular.
Domenii și proprietăți „multi-adeziune”
Proprietățile de multi-adeziune ale fibronectinei provin din prezența diferitelor domenii care au valori de afinitate ridicate pentru diferite substraturi și proteine..
„Brațele dimerice” pot fi împărțite în 7 domenii funcționale diferite. Acestea sunt clasificate în funcție de substratul sau domeniul de care se leagă fiecare. De exemplu: Domeniul 1 și Domeniul 8 sunt domenii de legare a proteinelor fibrinei.
Domeniul 2 are proprietăți de legare a colagenului, domeniul 6 este o regiune de adeziune celulară, adică îi permite să se ancoreze pe aproape orice membrană sau suprafață externă a celulelor. Funcțiile domeniilor 3 și 5 sunt încă necunoscute astăzi.
În domeniul 9, capătul carboxil sau capătul C-terminal al proteinei este localizat. Regiunile de adeziune celulară din domeniul 6 posedă tripeptida constând din secvența de aminoacizi Arginină-Glicină-Asparagină (Arg-Gly-Asp).
Această tripeptidă este împărtășită de mai multe proteine, cum ar fi colagenul și integrinele. Este structura minimă necesară pentru recunoașterea membranei plasmatice de către fibronectine și integrine..
Fibronectina, atunci când este în forma sa globulară, reprezintă o formă solubilă și liberă în sânge. Cu toate acestea, pe suprafețele celulare și în matricea extracelulară se găsește sub o formă „deschisă”, rigidă și insolubilă..
Caracteristici
Unele dintre procesele în care se remarcă participarea fibronectinelor sunt atașarea celulă la celulă, atașarea celulelor, conexiunea sau aderența la plasmă sau membranele bazale, stabilizarea cheagurilor de sânge și vindecarea rănilor..
Celulele aderă la un site specific pe fibronectină printr-o proteină receptoră cunoscută sub numele de „integrină”. Această proteină traversează membrana plasmatică către interiorul celulei.
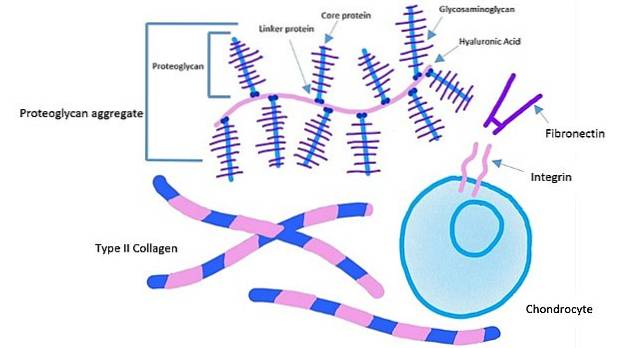
Domeniul extracelular al integrinelor se leagă de fibronectină, în timp ce domeniul intracelular al integrinelor este atașat la filamentele de actină. Acest tip de ancorare îi permite să transmită tensiunea generată în matricea extracelulară către citoscheletul celulelor..
Fibronectinele participă la procesul de vindecare a rănilor. Acestea, în forma lor solubilă, se depun pe fibrele de colagen adiacente plăgii, ajutând la migrarea fagocitelor, fibroblastelor și proliferării celulare în plaga deschisă..
Procesul efectiv de vindecare începe atunci când fibroblastele „rotesc” rețeaua de fibronectină. Această rețea acționează ca un fel de schelă sau suport pentru depunerea noilor fibre de colagen, heparan sulfat, proteoglican, condrotină sultafo și a celorlalte componente ale matricei extracelulare care sunt necesare pentru repararea țesutului..
Fibronectina este, de asemenea, implicată în mișcarea celulelor epidermice, deoarece prin țesutul granular ajută la reorganizarea membranei bazale care se află sub epidermă în țesuturi, ceea ce ajută la apariția keratinizării..
Toate fibronectinele au funcții esențiale pentru toate celulele; participă la procese atât de diverse precum migrația și diferențierea celulelor, homeostazia, vindecarea rănilor, fagocitoza, printre altele.
Referințe
- Conde-Agudelo, A., Romero, R. și Roberts, J. M. (2015). Teste pentru prezicerea preeclampsiei. În tulburările hipertensive ale lui Chesley în timpul sarcinii (pp. 221-251). Academic Press.
- Farfán, J. Á. L., Tovar, H. B. S., de Anda, M. D. R. G. și Guevara, C. G. (2011). Fibronectina fetală și lungimea cervicală ca predictori timpurii ai nașterii premature. Ginecologie și obstetrică din Mexic, 79 (06), 337-343.
- Feist, E. și Hiepe, F. (2014). Autoanticorpii fibronectinei. În Autoanticorpi (pp. 327-331). Elsevier.
- Letourneau, P. (2009). Căutare axonală: rol matricial extracelular. Enciclopedia neuroștiinței, 1, 1139-1145.
- Pankov, R. și Yamada, K. M. (2002). Fibronectina dintr-o privire. Journal of cell science, 115 (20), 3861-3863.
- Proctor, R. A. (1987). Fibronectina: o scurtă privire de ansamblu asupra structurii, funcției și fiziologiei sale. Recenzii ale bolilor infecțioase, 9 (Supliment_4), S317-S321.


Nimeni nu a comentat acest articol încă.