
Stratul Valencia din ce constă, exemple
valencia cape Este unul ai cărui electroni sunt responsabili pentru proprietățile chimice ale unui element. Electronii din această coajă interacționează cu cei ai unui atom vecin, formând astfel legături covalente (A-B); și dacă migrează de la un atom la altul mai electronegative, legături ionice (A + B-).
Acest strat este definit de numărul cuantic principal n, care la rândul său indică perioada în care elementul se află în tabelul periodic. În timp ce ordonarea grupului depinde de numărul de electroni care orbitează în învelișul de valență. Deci pentru un n egal cu 2, poate ocupa opt electroni: opt grupuri (1-8).
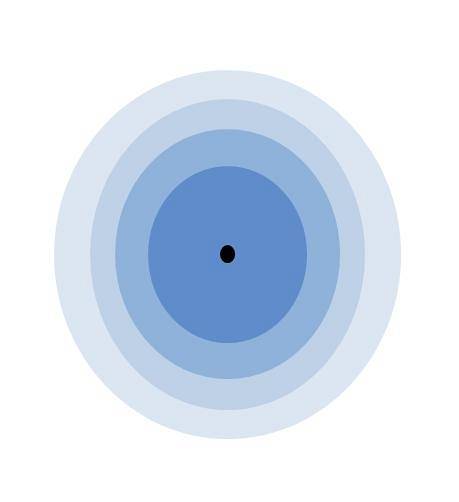
Imaginea de mai sus ilustrează semnificația stratului de valență. Punctul negru din centrul atomului este nucleul, în timp ce cercurile concentrice rămase sunt cochilii electronice definite de n.
Câte straturi are acest atom? Fiecare dintre ele are propria culoare și, deoarece există patru, atunci atomul are patru straturi (n= 4). Rețineți, de asemenea, că culoarea se degradează pe măsură ce crește distanța de la strat la miez. Stratul de valență este cel mai îndepărtat de nucleu: cel cu cea mai deschisă culoare.
Indice articol
- 1 Care este stratul de valență?
- 2 caracteristici
- 3 Exemple
- 3.1 Exemplul 1
- 3.2 Exemplul 2
- 4 Referințe
Care este stratul de valență?
Conform imaginii, învelișul de valență nu este altceva decât ultimii orbitali ai unui atom ocupat de electroni. În pelerina albastru deschis, spre n= 4, există o serie de orbitali 4s, 4p, 4d și 4f; adică în interior există alte substraturi cu capacități electronice diferite.
Un atom are nevoie de electroni pentru a umple toți orbitalii 4n. Acest proces poate fi observat în configurațiile electronice ale elementelor pe o perioadă.
De exemplu, potasiul are o configurație de electroni [Ar] 4s1, în timp ce calciu, în dreapta sa, [Ar] 4sDouă. Conform acestor setări, care este stratul de valență? Termenul [Ar] se referă la configurația electronică a gazului nobil argon 1sDouă2sDouă2 P63sDouă3p6. Acesta reprezintă stratul interior sau închis (cunoscut și sub numele de nucleu).
Deoarece orbitalul 4s este cel cu cea mai mare energie și în care intră noii electroni, acesta reprezintă învelișul de valență atât pentru K, cât și pentru Ca. Dacă atomii K și Ca ar fi comparați cu cel din imagine, [Ar] ar fie toate straturile interioare colorate în albastru; iar 4s stratul albastru deschis, exteriorul.
Caracteristici
Din toate cele menționate mai sus, unele caracteristici ale învelișului de valență pentru toți atomii pot fi rezumate:
-Nivelul tău de energie este mai mare; ceea ce este același, este îndepărtat în continuare din miez și are cea mai mică densitate de electroni (comparativ cu alte straturi).
-Este incomplet. Prin urmare, va continua să se umple cu electroni pe măsură ce o perioadă este parcursă de la stânga la dreapta în tabelul periodic..
-Intervine în formarea legăturilor covalente sau ionice.
În cazul metalelor potasiu și calciu, acestea sunt oxidate pentru a deveni cationi. K-ul+ are o configurație electronică [Ar], datorită pierderii singurului său electron extern 4s1. Și pe partea lui CaDouă+, configurația sa este, de asemenea, [Ar]; pentru că în loc să pierzi un electron, pierzi doi (4sDouă).
Dar care este diferența dintre K+ iar CaDouă+, dacă amândoi pierd electronii din coaja lor de valență și au configurație electronică [Ar]? Diferența constă în razele lor ionice. ACDouă+ este mai mic decât K+, deoarece atomul de calciu are un proton suplimentar care atrage electronii externi cu forță mai mare (învelișuri închise sau de valență).
Stratul de valență 4s nu a dispărut: este gol doar pentru acești ioni.
Exemple
Conceptul de coajă de valență poate fi găsit direct sau indirect în multe aspecte ale chimiei. Deoarece electronii săi sunt cei care participă la formarea legăturilor, orice subiect care le abordează (TEV, RPECV, mecanisme de reacție etc.) ar trebui să se refere la stratul menționat.
Acest lucru se datorează faptului că, mai importanți decât învelișul de valență, sunt electronii săi; numiți electroni de valență. Atunci când sunt reprezentate în construcția progresivă a configurațiilor electronice, acestea definesc structura electronică a atomului și, prin urmare, proprietățile sale chimice..
Din aceste informații despre un atom A și un alt B, structurile compușilor lor pot fi conturate prin structurile Lewis. De asemenea, structurile electronice și moleculare ale unei game de compuși pot fi determinate datorită numărului de electroni de valență..
Cele mai simple și posibile exemple de straturi de valență se găsesc în tabelul periodic; în mod specific, în configurații de electroni.
Exemplul 1
Este posibil să se identifice un element și locația acestuia în tabelul periodic numai cu configurația electronică. Astfel, dacă un element X are configurația [Kr] 5sDouă5 p1, Ce este și ce perioadă și grup aparține?
Având în vedere n= 5, X este în a cincea perioadă. În plus, are trei electroni de valență: doi în orbitalul 5sDouă și unul în 5p1. Stratul interior [Kr] nu oferă mai multe informații.
Deoarece X are trei electroni, iar orbitalii săi de 5p sunt incompleti, se află în blocul p; mai mult, în grupa IIIA (sistem romanic) sau 13 (sistem de numerotare actual și aprobat de IUPAC). X este apoi elementul indian, In.
Exemplul 2
Care este elementul X cu configurație electronică [Kr] 4d105s1? Rețineți că, la fel ca în, aparține perioadei 5, din orbitalul 5s1 este cea cu cea mai mare energie. Cu toate acestea, învelișul de valență include și orbitalii 4d, deoarece sunt incomplet.
Straturile de valență pot fi apoi desemnate ca nsnp, pentru un element al blocului p sau s; sau (n-1) dns, pentru un element al blocului d. Deci misteriosul element X aparține blocului d deoarece configurația sa electronică este de tipul (n-1) dns (4d105s1).
La ce grup aparțineți? Adăugarea celor zece electroni ai orbitalului 4d10, și unul de la 5s1, X are unsprezece electroni de valență. Prin urmare, trebuie plasat în grupul IB sau 11. Apoi, trecând prin perioada 5 a tabelului periodic în grupa 11, se împiedică de elementul argintiu, Ag.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (ediția a patra, p. 23). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p. 287.
- Centrul de resurse NDT. (s.f.). Coaja Valence. Luat de pe: nde-ed.org
- Clackamas Community College. (2002). Electroni de valență. Recuperat de la: dl.clackamas.edu
- Chimie LibreTexte. (s.f.). Valence și nucleul de electroni. Recuperat de pe: chem.libretexts.org



Nimeni nu a comentat acest articol încă.