
Structura, proprietățile, utilizările fluorurii de calciu (CaF2)
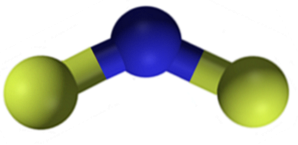
fluor de calciu Este un solid anorganic format dintr-un atom de calciu (Ca) și doi atomi de fluor (F). Formula sa chimică este CaFDouă și este un solid cristal alb-cenușiu.
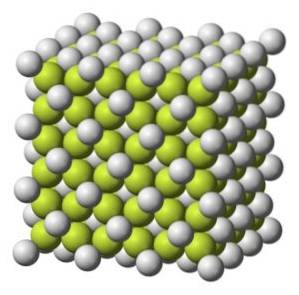
În natură, se găsește în fluoritul mineral sau fluorspar. Există în mod natural în oase și dinți. Fluoritul mineral este principala sursă utilizată pentru obținerea altor compuși ai fluorului.

În plus, CaFDouă Se folosește pentru prevenirea cariilor din dinți, de aceea se adaugă la materialele folosite de stomatologi pentru vindecarea lor. De fapt, fluorura de calciu se adaugă și în apa potabilă (apă care poate fi băută), astfel încât populația beneficiază de ingerarea acesteia și spălarea dinților..
CaFDouă Este utilizat sub formă de cristale mari în echipamente optice și camere. Este, de asemenea, utilizat în dispozitivele mici, care sunt utilizate pentru a detecta cât de mult a fost expusă o persoană la radioactivitate.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Indicele de refracție
- 3.7 Solubilitate
- 3.8 Proprietăți chimice
- 4 Prezență în natură
- 5 utilizări
- 5.1 - În obținerea compușilor cu fluor
- 5.2 - În îngrijirea dinților
- 5.3 - În lentilele pentru echipamente optice
- 5.4 - În industria metalurgică
- 5.5 - În detectoarele de radioactivitate sau radiații periculoase
- 5.6 - Alte utilizări
- 6 Referințe
Structura
Fluorură de calciu CaFDouă este un compus ionic format dintr-un cation de calciu CaDouă+ și doi anioni fluorură F-. Cu toate acestea, unele surse de informații indică faptul că legăturile lor au un anumit caracter covalent.
Nomenclatură
Fluorură de calciu
Proprietăți
Starea fizică
Solid incolor până la alb-cenușiu cu structură cristalină cubică.
Greutate moleculară
78,07 g / mol
Punct de topire
1418 ºC
Punct de fierbere
2533 ºC
Densitate
3,18 g / cm3 la 20 ° C.
Indicele de refracție
1,4328
Solubilitate
Este insolubil în apă la 20 ° C. Aproape insolubil la 25 ° C: 0,002 g / 100 ml apă. Ușor solubil în acizi.
Proprietăți chimice
Proprietățile sale oxidante sau reducătoare sunt foarte slabe, cu toate acestea, pot apărea aceste reacții. Deși, în general, în foarte puține cazuri.
Este inert față de substanțele chimice organice și mulți acizi, inclusiv acidul fluorhidric HF. Se dizolvă lent în acidul azotic HNO3.
Nu este inflamabil. Nu reacționează rapid cu aerul sau apa.
Datorită afinității sale scăzute pentru apă, chiar dacă este expusă la un procent ridicat de umiditate, nu o afectează nici măcar până la o lună la temperatura camerei normale..
În prezența umidității, pereții cristalelor sale se dizolvă încet la temperaturi de peste 600 ° C. În medii uscate poate fi utilizat până la aproximativ 1000 ° C fără a fi afectat în mod semnificativ.
Prezență în natură
Fluorură de calciu CaFDouă găsit în mod natural în fluoritul mineral sau fluor.
Deși CaFDouă purul este incolor mineralul fluorit, este adesea colorat de prezența electronilor prinși în „găurile” structurii cristaline.
Acest mineral este foarte apreciat pentru luciul său sticlos și varietatea de culori (violet, albastru, verde, galben, incolor, maro, roz, negru și portocaliu roșcat). Se spune că este „cel mai colorat mineral din lume”.





Fluorul de calciu se găsește și în oase în cantități cuprinse între 0,2 și 0,65%, precum și în smalțul dinților în 0,33-0,59%.
Aplicații
- În obținerea compușilor de fluor
Fluoritul mineral CaFDouă Este sursa de bază sau majoritară de fluor la nivel mondial. Este materia primă pentru a prepara aproape toți compușii fluorului.
Cel mai important dintre acestea este acidul fluorhidric HF, din care sunt preparați ceilalți compuși fluorurați. Ionul fluor F- eliberat din mineral prin reacția acestuia cu acidul sulfuric concentrat HDouăSW4:
CaFDouă (solid) + HDouăSW4 (lichid) → CaSO4 (solid) + 2 HF (gaz)
- În îngrijirea dinților
Fluorură de calciu CaFDouă este un agent pentru prevenirea cariilor. Se folosește pentru fluorurarea apei potabile (apă care poate fi băută) în acest scop.
Mai mult, concentrațiile scăzute de fluor F- (de ordinul a 0,1 părți la milion) utilizate în pastele de dinți și spălările de gură s-au dovedit a avea un efect pozitiv profund asupra îngrijirii dentare preventive a cavităților.

Nanoparticule de CaFDouă mai efectiv
Deși fluorurile sunt utilizate în pastele de dinți și clătiri, concentrația scăzută de calciu (Ca) din salivă înseamnă că nu se formează depozite de CaF.Două pe dinți cât mai eficient posibil.
De aceea a fost conceput un mod de a obține pulbere de CaF.Două ca nanoparticule.
Pentru aceasta se folosește un uscător cu pulverizare (din engleză uscător cu spray) unde două soluții (una de hidroxid de calciu Ca (OH)Două și unul de fluorură de amoniu NH4F) sunt amestecate în timp ce sunt pulverizate într-o cameră cu flux de aer cald.
Apoi apare următoarea reacție:
Ca (OH)Două + NH4F → CaFDouă (solid) + NH4Oh
NH4OH se volatilizează ca NH3 si HDouăSau și nanoparticulele CaF rămânDouă.
Acestea au o reactivitate ridicată și o solubilitate mai mare, ceea ce le face mai eficiente pentru remineralizarea dinților și ca anticari.
- În lentilele pentru echipamente optice
Fluorul de calciu este utilizat pentru a construi elemente optice precum prismele și ferestrele spectrofotometrelor de lumină cu infraroșu și ultraviolete (UV)..
Aceste dispozitive ne permit să măsurăm cantitatea de lumină absorbită de un material când trece prin el.
CaFDouă este transparent în aceste regiuni ale spectrului luminos, are un indice de refracție extrem de scăzut și permite o rezoluție mai eficientă decât NaCl în intervalul 1500-4000 cm.-1.
Datorită stabilității sale chimice, poate rezista condițiilor nefavorabile, motiv pentru care elementele optice CaFDouă nu sunt atacați. Are și o duritate ridicată.
În camere
Unii producători de camere folosesc lentile CaFDouă cristalizat artificial pentru a reduce împrăștierea luminii și pentru a obține o corecție excelentă a distorsiunii culorii.

- În industria metalurgică
CaFDouă Este utilizat ca agent de flux în industria metalurgică, deoarece este o sursă de calciu insolubil în apă și, prin urmare, eficientă în aplicații sensibile la oxigen..
Se folosește pentru a topi și prelucra fierul și oțelul sub formă lichidă. Acest lucru se bazează pe faptul că are un punct de topire similar cu cel al fierului și, de asemenea, că poate dizolva oxizi și metale..
- În detectoarele de radioactivitate sau radiații periculoase
CaFDouă este un material termoluminiscent. Aceasta înseamnă că poate absorbi radiațiile din electronii structurii sale cristaline și mai târziu, atunci când este încălzită, o poate elibera sub formă de lumină..
Această lumină emisă poate fi măsurată printr-un semnal electric. Acest semnal este proporțional cu cantitatea de radiație primită de material. Înseamnă că, cu cât este mai mare cantitatea de radiație primită, cu atât este mai mare cantitatea de lumină pe care o va emite după încălzire..
Din acest motiv, CaFDouă Este utilizat în așa-numitele dozimetre personale, care sunt utilizate de persoanele care sunt expuse la radiații periculoase și doresc să știe câtă radiație au primit într-o perioadă de timp.
- Alte utilizări
- Este utilizat ca catalizator în reacțiile chimice de deshidratare și deshidrogenare pentru sinteza compușilor organici.
- Este utilizat în electrozii de sudură alcalină. Se obține o sudură mai puternică decât cu electrozii acizi. Acești electrozi sunt utili în fabricarea navelor și a vaselor de oțel de înaltă presiune..
- Ca supliment alimentar în cantități extrem de mici (ppm sau părți pe milion).

Referințe
- Pirmoradian, M. și Hooshmand, T. (2019). Remineralizarea și capacitățile antibacteriene ale nanocompozitelor dentare pe bază de rășină. Sinteza și caracterizarea fluorurii de calciu (CaFDouă). În aplicațiile materialelor nanocompozite în stomatologie. Recuperat de la sciencedirect.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Fluorură de calciu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Weman, K. (2012). Sudare manuală cu arc metalic (MMA) cu electrozi acoperiți. În manualul proceselor de sudare (ediția a doua). Recuperat de la sciencedirect.com.
- Hanning, M. și Hanning, C. (2013). Nanobiomateriale în stomatologie preventivă. Fluorură de calciu nanozizată. În Nanobiomateriale în stomatologie clinică. Recuperat de la sciencedirect.com.
- Ropp, R.C. (2013). Grupa 17 (H, F, Cl, Br, I) Compuși alcalini-pământeni. Fluorură de calciu. În Enciclopedia compușilor alcalini ai pământului. Recuperat de la sciencedirect.com.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Valkovic, V. (2000). Măsurători ale radioactivității. În radioactivitate în mediu. Detectoare termoluminiscente (TLD). Recuperat de la sciencedirect.com.


Nimeni nu a comentat acest articol încă.