
Structura fluorurii de magneziu, proprietăți, sinteză, utilizări
fluorură de magneziu este o sare anorganică incoloră a cărei formulă chimică este MgF₂. Se găsește în natură ca sellait mineral. Are un punct de topire foarte ridicat și este foarte puțin solubil în apă. Este relativ inert, deoarece, de exemplu, reacția sa cu acidul sulfuric este lentă și incompletă și rezistă la hidroliză cu acid fluorhidric (HF) până la 750 ° C..
Este un compus puțin afectat de radiații cu energie ridicată. În plus, are un indice de refracție scăzut, rezistență ridicată la coroziune, stabilitate termică bună, duritate semnificativă și proprietăți excelente de transmitere a luminii vizibile, UV (ultraviolete) și IR (infraroșu)..
Aceste proprietăți îl fac să aibă performanțe excelente în câmpul optic și, în plus, îl fac un material util ca suport catalizator, element de acoperire, lentile antireflexive și ferestre pentru transmisie în infraroșu, printre alte aplicații..
Indice articol
- 1 Structură
- 2 Proprietăți
- 3 Sinteza și pregătirea
- 4 utilizări
- 4.1 Optică
- 4.2 Cataliza sau accelerarea reacțiilor
- 4.3 Alte utilizări
- 5 Referințe
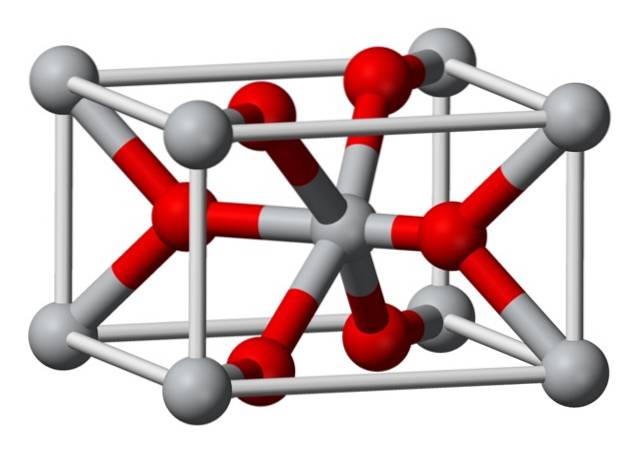
Structura
Structura cristalină a fluorurii de magneziu preparate chimic este de același tip cu cea a sellaitei minerale naturale. Cristalizează în clasa dipiramidală a sistemului tetragonal.
Ionii de magneziu (Mg2 +) sunt localizați într-un spațiu reticulat tetragonal centrat, în timp ce ionii de fluor (F-) se găsesc în același plan ca și asociați cu vecinii lor Mg2 +, grupați în perechi între ei. Distanța dintre ionii Mg2 + și F- este de 2,07 Å (angstromi) (2,07 × 10-10m).
Coordonarea sa cristalină este de 6: 3. Aceasta înseamnă că fiecare ion Mg2 + este înconjurat de 6 ioni F și fiecare ion F-, la rândul său, este înconjurat de 3 ioni Mg2 + 5..
Structura este foarte asemănătoare cu cea a rutilului mineral, care este forma naturală a dioxidului de titan (TiO2), cu care are mai multe proprietăți cristalografice în comun..
În timpul producției sale, fluorura de magneziu nu precipită ca un solid amorf, deoarece ionii Mg2 + și F- nu tind să formeze complexe polimerice în soluție..
Proprietăți
Interesant este faptul că fluorura de magneziu este un material birefringent. Aceasta este o proprietate optică care permite împărțirea unei raze de lumină incidente în două raze separate care se propagă la viteze și lungimi de undă diferite..
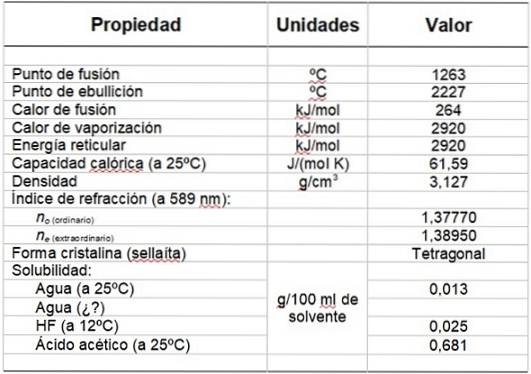
Tabelul 1 prezintă câteva dintre proprietățile sale.
Tabelul 1. Proprietățile fizice și chimice ale fluorurii de magneziu.
Sinteza și pregătirea
Poate fi pregătit în diferite moduri, inclusiv următoarele:
1-Prin reacția dintre oxidul de magneziu (MgO) sau carbonatul de magneziu (MgCO3) cu acidul fluorhidric (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-Prin reacție între carbonat de magneziu și bifluorură de amoniu (NH4HF2), ambele în stare solidă, la o temperatură între 150 și 400ºC2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Încălzirea unei soluții apoase de carbonat de magneziu și fluorură de amoniu (NH4F) în prezența hidroxidului de amoniu (NH4OH) la 60ºC 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Precipitatul rezultat de fluorură de magneziu amoniu (NH4MgF3) este apoi încălzit la 620 ° C timp de 4 ore pentru a obține fluorură de magneziu:
620ºC
NH4MgF3 MgF2 + NH3 + HF
4-Ca produs secundar al obținerii berilului (Be) și uraniului (U). Fluorul elementului dorit este încălzit cu magneziu metalic într-un creuzet acoperit cu MgF2 2:
BeF2 + Mg Be + MgF2
5-Reacția clorurii de magneziu (MgCl2) cu fluorură de amoniu (NH4F) într-o soluție apoasă la temperatura camerei 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Deoarece metodele de preparare a MgF2 sunt scumpe, există încercări de a o obține mai economic, printre care se remarcă metoda de producere a acesteia pornind de la apa de mare..
Aceasta se caracterizează prin adăugarea unei cantități suficiente de ioni fluor (F-) în apa de mare, care are o concentrație abundentă de ioni magneziu (Mg2 +), favorizând astfel precipitarea MgF2..
Cristalele optice de fluorură de magneziu sunt obținute prin presarea la cald a pulberii de MgF2 de înaltă calitate, obținută, de exemplu, prin metoda NH4HF2.
Există multe tehnici pentru prepararea materialelor cu fluorură de magneziu, cum ar fi creșterea monocristalului, sinterizarea (compactarea la matrițare sau modelare) fără presiune, presarea la cald și sinterizarea cu microunde..
Aplicații
Optică
Cristalele MgF2 sunt potrivite pentru aplicații optice, deoarece sunt transparente de la regiunea UV la regiunea IR mijlocie 2.10.
Ca film inert, este folosit pentru a modifica proprietățile de transmitere a luminii materialelor optice și electronice. Una dintre principalele aplicații este în optica VUV pentru tehnologia de explorare a spațiului.
Datorită proprietății sale de birrefringență, acest material este util în optica de polarizare, în ferestrele și prismele laserului Excimer (un tip de laser ultraviolet utilizat în chirurgia ochiului)..
Trebuie remarcat faptul că fluorura de magneziu utilizată la fabricarea materialelor optice cu film subțire trebuie să fie lipsită de impurități sau compuși care sunt o sursă de oxid, cum ar fi apa (H2O), ioni hidroxid (OH-), ioni carbonat (CO3 = ), ioni sulfat (SO4 =) și altele asemenea 12.
Cataliza sau accelerarea reacțiilor
MgF2 a fost folosit cu succes ca suport catalizator pentru reacția de eliminare a clorului și adăugarea de hidrogen în CFC (clorofluorocarburi), agenți frigorifici cunoscuți și propulsori pentru aerosoli și responsabil pentru deteriorarea stratului de ozon al atmosferei.
Compușii rezultați, HFC (hidrofluorocarburi) și HCFC (hidroclorofluorocarburi), nu prezintă acest efect dăunător atmosferei 5.
De asemenea, a fost util ca suport catalizator pentru hidrodesulfurarea (îndepărtarea sulfului) compușilor organici..
Alte utilizări
Materialele generate de intercalația grafitului, fluorului și MgF2 prezintă o conductivitate electrică ridicată, motiv pentru care au fost propuse pentru utilizare în catoduri și ca materiale electroconductoare..
Eutecticul format din NaF și MgF2 are proprietăți de stocare a energiei sub formă de căldură latentă, motiv pentru care a fost considerat pentru utilizare în sistemele de energie solară..
În domeniul biochimiei, fluorura de magneziu, împreună cu alte fluoruri metalice, este utilizată pentru a inhiba reacțiile de transfer fosforilic în enzime..
Recent, nanoparticulele MgF2 au fost testate cu succes ca vectori de eliberare a medicamentelor în celulele bolnave pentru tratamentul cancerului..
Referințe
- Buckley, S.E. și Vernon, W.S. (1925) XCIV. Structura cristalină a fluorurii de magneziu. Revista Filozofică Seria 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Enciclopedia tehnologiei chimice, volumul 11, ediția a cincea, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; și Song, Jinhong. (2015). Pregătirea ceramicii translucide MgF2 prin sinterizare prin presare la cald. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 No. 4.
- Непоклонов, И.С. (2011). Fluorură de magneziu. Sursa: Lucrare proprie.
- Wojciechowska, Maria; Zielinski, Michal; și Pietrowski, Mariusz. (2003). MgF2 ca suport catalitic neconvențional. Jurnalul de chimie a fluorului, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorură de magneziu (MgF2). Adus 12-07-2019 la: korth.de
- Sevonkaev, Igor și Matijevic, Egon. (2009). Formarea particulelor de fluorură de magneziu de diferite morfologii. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Fluorură de magneziu. Sursa: Lucrare proprie.
- Tao Qin, Peng Zhang și Weiwei Qin. (2017). O metodă nouă de sintetizare a sferelor de fluorură de magneziu low-cost din apa de mare. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) Ediția a cincea. Volumul A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingineri care inspectează oglinda primară a telescopului spațial Hubble 8109563. Sursa: mix.msfc.nasa.gov


Nimeni nu a comentat acest articol încă.