
Structura fosfatului de potasiu (K3PO4), proprietăți, utilizări
Fosfat de potasiu este un compus anorganic format din trei ioni K de potasiu+ și un ion fosfat PO43-. Formula sa chimică este K3PO4. Este un solid cristalin incolor sau alb. Este foarte solubil în apă, formând soluții alcaline, adică cu mulți ioni OH-, deci pH-ul bazic.
Ionul fosfat are o funcție importantă în celule, care are legătură cu stocarea energiei. Fosfatul de potasiu este utilizat pe scară largă în reacțiile de chimie organică, unde poate acționa ca bază, adică luând protoni H+. Poate funcționa și ca catalizator sau accelerator al unor reacții.

A fost folosit pentru a reduce atacul anumitor insecte asupra plantelor de grâu, deoarece le face mai rezistente la acestea. Cu toate acestea, s-a observat că favorizează evoluția metanului (CH4), un gaz cu efect de seră, provenit din microculturi de orez.
A fost folosit ca laxativ, pentru a crește durata anesteziei locale, pentru a opri cavitățile și pentru a ajuta la acoperirea suprafețelor, printre alte aplicații.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3,6 pH
- 3.7 Proprietăți chimice
- 3.8 Alte proprietăți
- 3.9 Rolul fosfatului în corpul uman
- 4 Obținerea
- 5 utilizări
- 5.1 Ca bază în reacțiile de chimie organică
- 5.2 Ca catalizator
- 5.3 În agricultură
- 5.4 În aplicații medicale
- 5.5 Ca laxativ
- 5.6 În medicina veterinară
- 5.7 În obținerea ADN-ului
- 5.8 În diverse aplicații
- 5.9 Aspect negativ pentru utilizare în agricultură
- 6 Referințe
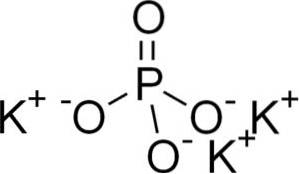
Structura
Fosfatul de potasiu este alcătuit din trei cationi de potasiu K.+ și un anion fosfat PO43-.
Ionul fosfat PO43- Este alcătuit dintr-un atom de fosfor (P) și patru atomi de oxigen (O), unde fosforul are o stare de oxidare de +5 și oxigenii o valență de -2.
Nomenclatură
- Fosfat de potasiu
- Fosfat tripotasic
- Fosfat de potasiu tribazic
- Ortofosfat tripotasic
Proprietăți
Starea fizică
Solid cristalin incolor sau alb.
Greutate moleculară
212,27 g / mol
Punct de topire
1340 ºC
Densitate
2.564 g / cm3
Solubilitate
Foarte solubil în apă: 106 g / 100 g apă la 25 ° C. Insolubil în etanol.
pH
O soluție cu 1% K3PO4 are un pH de 11,5-12,3.
Proprietăți chimice
Când este dizolvat în apă, fosfatul de potasiu se separă în cei trei cationi de potasiu K.+ și anionul fosfat PO43-. Anionul fosfat ia un proton din apă și se formează anionul hidrogen fosfat HPO4Două-. Acesta din urmă ia la rândul său un alt proton din apă și devine anionul dihidrogen fosfat HDouăPO4-.
PO43- + HDouăO ⇔ HPO4Două- + Oh-
HPO4Două- + HDouăO ⇔ HDouăPO4- + Oh-
Pe măsură ce se formează ioni OH- soluția apoasă devine alcalină.
Alte proprietăți
Pe lângă forma anhidră (fără apă), are mai multe forme hidratate; aceasta înseamnă că molecula K3PO4 poate fi însoțită de una sau mai multe molecule de apă în structura cristalină.
Din acest motiv poate forma, de exemplu, monohidratul K3PO4.HDouăSau, trihidratul K3PO4.3HDouăSau, heptahidratul și nonahidratul.
Rolul fosfatului în corpul uman
Ionul fosfat PO43- este cel mai abundent anion din interiorul celulelor și joacă un rol important în stocarea energiei.
Ioniul fosfat participă, de asemenea, la activitățile de formare și nutriție ale oaselor și dinților, deoarece reglează concentrația de calciu din serul sanguin și în numeroase reacții de transfer de energie în celulă..
Obținerea
Fosfatul de potasiu poate fi obținut pornind de la reacția dintre clorura de potasiu KCl și fosfatul de amoniu (NH4)3PO4.
Clorură de potasiu + fosfat de amoniu → fosfat de potasiu + clorură de amoniu
3 KCI + (NH4)3PO4 → K3PO4 + 3 NH4Cl
Aplicații
Ca bază în reacțiile de chimie organică
K fosfat de potasiu3PO4 A fost utilizat în diferite reacții de chimie organică. De exemplu, servește la sinteza acetilenelor pornind de la compuși dibromurați..
În această sinteză, apare o deshidrobromare (eliminarea hidrogenului și a bromului), unde K3PO4 solidul anhidru (fără apă) acționează ca o bază moale și ia doi protoni din moleculă, se elimină cei doi atomi de brom și se obține acetilena corespunzătoare.
C6H5-CHBr-CHDouăBr + 2 K3PO4 → C6H5-C≡CH + 2 KBr + 2 KDouăHPO4

Ca catalizator
K-ul3PO4 servește drept catalizator în diferite reacții de chimie organică. De exemplu, a fost folosit ca solid pentru obținerea biodieselului din uleiul de prăjit uzat..
Biodieselul este un combustibil similar cu motorina, dar obținut din grăsimi sau uleiuri naturale utilizate sau nu.
Fosfatul de potasiu a fost mai eficient ca catalizator sau accelerator al acestei reacții decât fosfatul de sodiu Na3PO4 și oxid de calciu CaO.
În agricultură
K-ul3PO4 a fost folosit pentru tratarea plantelor de grâu și pentru a le face rezistente la anumiți dăunători.

Unii cercetători au tratat răsadurile de grâu cu fosfat de potasiu și sa dovedit că induce rezistență împotriva afidelor. Diuraphis noxia, o insectă care atacă aceste plante.
După aplicarea unei soluții diluate de K3PO4 severitatea simptomelor cauzate de aceste insecte și o scădere a numărului de afide care se hrănesc cu ele a fost observată pe răsaduri.

În aplicații medicale
Fosfatul de potasiu a fost utilizat pentru a modifica efectul anestezic al lidocainei, un anestezic local. Un anestezic local este un medicament care, atunci când este aplicat pe o zonă a corpului, determină pierderea sensibilității la durere în acea zonă..
S-a constatat că K3PO4 permite prelungirea anesteziei locale a lidocainei.
Ca laxativ
Fosfatul de potasiu crește fluiditatea conținutului intestinal, deoarece ajută la reținerea apei în intestin, ceea ce induce indirect contracția mușchiului intestinal.
În medicina veterinară
K-ul3PO4 este utilizat la animalele cu cetoacidoză diabetică (o complicație a diabetului zaharat) pentru tratarea hipofosfatemiei (cantitate scăzută de fosfat în sânge).
Cu toate acestea, atunci când este administrat în exces poate provoca hipocalcemie (calciu scăzut în sânge), hiperfosfatemie (fosfat în exces în sânge), contracție involuntară a mușchilor, mineralizarea țesuturilor moi și insuficiență renală..
În obținerea ADN-ului
Fosfatul de potasiu a fost folosit ca tampon pentru purificarea ADN-ului în laboratoarele de genetică.
ADN-ul este o proteină care se găsește în celule și conține toate informațiile genetice necesare dezvoltării și funcționării ființelor vii..
Prin izolarea ADN-ului, oamenii de știință aprofundează studiul modului în care sunt transmise trăsăturile ereditare, motiv pentru care fosfatul de potasiu este foarte util.
În diverse aplicații
K fosfat de potasiu3PO4 serveste:
- ca supliment alimentar,
- pentru înlocuirea electroliților,
- ca tampon, adică ca sistem chimic care permite controlul nivelurilor ionilor OH- sau hidrogen H+ în soluție apoasă,
- pentru a încetini sau inhiba cariile dentare,
- ca inhibitor de coroziune și agent antifouling,
- ca agent de tratare a suprafeței și agent de acoperire,
- ca antigel,
- în produsele de curățare.

Aspect negativ pentru utilizare în agricultură
Unii cercetători au descoperit că adăugarea de K3PO4 o microcultură de orez crește emisia de metan (CH4) la atmosferă. Metanul este un gaz care contribuie la efectul de seră și crește temperatura planetei noastre.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Fosfat de potasiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Terapia cu fluide în tulburările endocrine și metabolice. Suplimentarea cu fosfor. În tulburările de lichid, electrolit și acid-bază în practica animalelor mici (ediția a patra). Recuperat de la sciencedirect.com.
- Shenawi-Khalil, S. și colab. (2012). Sinteza acetilenelor prin dehidrobromare folosind fosfat de potasiu solid anhidru ca bază în condiții de transfer de fază. Tetrahedron Letters, volumul 53, numărul 18, 2012, paginile 2295-2297. Recuperat de la sciencedirect.com.
- Guan, G. și colab. (2009). Fosfatul tri-potasic ca catalizator solid pentru producerea de biodiesel din ulei de gătit uzat. Tehnologia procesării combustibilului, volumul 90, numărul 4, 2009, paginile 520-524. Recuperat de la sciencedirect.com.
- Kulkami, M.A. (2012). Abordare mecanicistă pentru sinteza rapidă și fără solvent a α-hidroxi fosfonaților folosind fosfat de potasiu ca catalizator. Comptes Rendus Chimie, Vol 16, Numărul 2, 2013, paginile 148-152. Recuperat de la sciencedirect.com.
- Venter, E. și colab. (2014). Fosfatul de potasiu induce toleranță împotriva afidului de grâu rusesc (Diuraphis noxia, Homoptera: Aphididae) în grâu. Protecția culturilor Vol 61, iulie 2014, paginile 43-50. Recuperat de la sciencedirect.com.
- Bonturi, N. și colab. (2013). Citrat de sodiu și fosfat de potasiu ca tampoane de adsorbție alternative în purificarea cromatografică tiofilă hidrofobă și aromatică a ADN-ului plasmidic din lizatul neutralizat. Jurnalul de cromatografie B, volume 919-920, 2013, paginile 67-74. Recuperat de la sciencedirect.com.
- Conrad, R. și Klose, M. (2005). Efectul fertilizării cu fosfat de potasiu asupra producției și emisiilor de metan și a acestuia 13Compoziție izotopică stabilă în C în microcosmosul orezului. Biologia solului și biochimia, vol. 37, numărul 11, 2005, paginile 2099-2108. Recuperat de la sciencedirect.com.
- Lide, D.R. (editor) (2003). Manualul de chimie și fizică al CRC. 85a CRC Press.
- Smokefoot. (2019). Fosfat tripotasic. Recuperat de pe en.wikipedia.org

Nimeni nu a comentat acest articol încă.