
Structura fosfatului de sodiu, proprietăți, sinteză, utilizări

Fosfat de sodiu este o sare anorganică a cărei formulă chimică este Na3PO4. Se mai numește fosfat trisodic (TSP): Fosfat trisodic), sau fosfat de sodiu tribazic, deoarece îi lipsește complet capacitatea de a dona ioni de hidrogen H+.
Când este menționat în mod plural, fosfați de sodiu, se referă la întregul compendiu de săruri, hidratate sau nu, provenind din interacțiunile electrostatice dintre Na+ și PO43-. Unele dintre aceste săruri constau chiar din pirofosfați de sodiu sau polimeri anorganici care au PO43- ca monomer.

De aceea, dacă nu se face o specificație, se va referi întotdeauna la Na3PO4, și nu NaHDouăPO4, NaDouăHPO4, N / A4PDouăSAU7 nici la nicio altă sare.
Imaginea de mai sus arată aspectul fosfatului de sodiu, care prezintă cristale albe asemănătoare cu sarea obișnuită sau de masă sau este achiziționat sub formă de pulbere albă, cu aspect amorf. Apoi o3PO4 este capabil să formeze diferiți hidrați, fiind Na3PO412HDouăSau cel care se comercializează cel mai mult.
Se folosește în principal în industria alimentară, în detergenți, suplimente sportive și servește ca laxativ hiperosmotic.
Indice articol
- 1 Structura chimică
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Punctul de topire
- 2.3 Punctul de fierbere
- 2.4 Solubilitatea în apă
- 2.5 Densitate
- 2.6 Stabilitate
- 2,7 pH
- 3 Sinteza
- 4 utilizări
- 4.1 Mâncare
- 4.2 Detergenți
- 4.3 Medicamentos
- 5 Referințe
Structura chimică
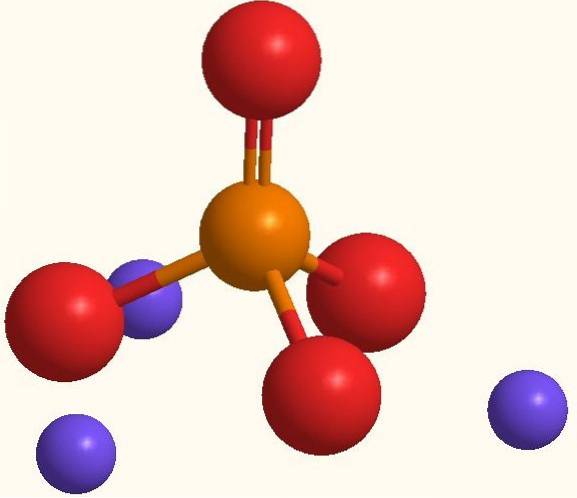
Aceeași formulă Na3PO4 indică faptul că pentru fiecare anion PO43- există trei cationi Na+. Acești ioni pot fi văzuți în imaginea de mai sus. Rețineți că PO43- are geometrie tetraedrică, cu atomii săi de oxigen care poartă o sarcină negativă rezonantă, care atrage Na+ a mediului.
La fel, formula Na3PO4 subliniază că este sarea anhidră, deci nu există molecule de apă incluse în cristalele sale. Atracțiile electrostatice dintre Na+ și PO43- ajung să definească un cristal trigonal alb. Legătura sa ionică este astfel încât Na3PO4 are un punct de topire de 1583 ºC, considerabil mai mare decât cel al diferitelor săruri.
Atât Na+ ca PO43- Sunt ioni care pot fi foarte hidrați, fără a afecta negativ stabilitatea cristalelor.
Din acest motiv se pot cristaliza și hidrații; cu toate acestea, punctele sale de topire sunt mai mici decât cele ale sării anhidre, deoarece legăturile de hidrogen intermoleculare din apă separă ionii și le slăbesc interacțiunile. În Na3PO412HDouăSau, de exemplu, punctul său de topire este de 73,4 ºC, mult mai mic decât cel al Na3PO4.
Proprietăți
Aspectul fizic
Poate apărea ca cristale albe definite sau ca pulbere sau granule de aceeași culoare. Toate cantitățile fizice exprimate mai jos se referă doar la sarea anhidră Na3PO4.
Punct de topire
1583 ºC
Punct de fierbere
100 ° C
Solubilitatea apei
14,5 g / 100 mL la 25 ° C, motiv pentru care este considerat un fosfat destul de solubil în apă. Cu toate acestea, este insolubil în solvenți organici precum etanol și disulfură de carbon..
Densitate
2,536 g / cm3 la 17,5 ºC.
Stabilitate
Este un solid higroscopic. Prin urmare, trebuie depozitat în așa fel încât să nu poată fi expus la umezeală.
pH
Este o sare puternic alcalină. De exemplu, o soluție apoasă 0,1% are deja pH 11,5. Această proprietate servește ca aditiv în detergenți.
Sinteză
Cum se produce sau se sintetizează fosfatul de sodiu? Pentru a face acest lucru, pornim de la acidul fosforic, H3PO4, sau a sării fosfat diacid de sodiu, NaHDouăPO4.
În marea majoritate a sintezelor, H este preferat3PO4. Astfel, H este reacționat3PO4 cu o bază care neutralizează cele trei grupări ale sale OH, ținând cont de faptul că acest acid poate fi scris și ca PO (OH)3.
Baza, de preferință, este hidroxidul de sodiu, NaOH (în Germania), dar este, de asemenea, fezabil (și mai ieftin) să se utilizeze carbonat de sodiu sau sodă, NaDouăCO3 (în Statele Unite). Ecuațiile pentru ambele reacții de neutralizare sunt:
N / ADouăCO3 + H3PO4 → NaDouăHPO4 + CODouă + HDouăSAU
N / ADouăHPO4 + NaOH → Na3PO4 + HDouăSAU
Rețineți că atunci când utilizați NaDouăCO3 Na nu se obține3PO4 dar NaDouăHPO4, care va avea nevoie de o neutralizare ulterioară. Deoarece mediul de reacție este apos, Na cristalizează3PO412HDouăSau, așa că trebuie calcinat pentru a îndepărta conținutul său de apă și astfel se obține sarea anhidră.
Apoi o3PO412HDouăSau se caracterizează prin „fuzionarea” cristalelor sale într-o masă compactă greu de rupt. Cu cât dimensiunea cristalelor este mai mică, cu atât va fi mai rapidă calcinarea lor.
Aplicații
Alimente

În utilizarea fosfatului de sodiu este inevitabil să se amestece Na3PO4 sau către Na3PO412HDouăSau, din moment ce acesta din urmă este cel mai comercializat hidrat. De exemplu, oricare dintre cei doi contribuie cu ioni inofensivi (teoretic) la alimentele la care sunt adăugați, îmbogățindu-i cu fosfați și crescându-le salinitatea în același timp..
În sarea cărnii, Na3PO412HDouăSau incluse pentru a le menține proaspete mai mult timp în timpul depozitării. La fel, se adaugă ca agent emulsionant, astfel încât amestecul de ulei-apă să nu „taie”, ci mai degrabă să rămână unit; și ca regulator al pH-ului, deoarece ajută la reducerea acidității alimentelor (inclusiv a cerealelor).
În plus, este folosit pentru îngroșarea unor sosuri de roșii și pentru coacerea prăjiturilor sau a pâinilor (imaginea de sus). Aceasta din urmă se datorează Na3PO412HDouăSau tinde să elibereze vapori de apă, ceea ce mărește dimensiunea porilor și volumul aluatului de făină..
Detergenți
Fosfatul de sodiu este suficient de bazic pentru a saponifica unele grăsimi sau uleiuri cu care intră în contact. Alcalinitatea sa este apoi utilizată pentru a îmbunătăți acțiunea detergenților, atâta timp cât suprafața de degresat nu este metalică, deoarece o poate deteriora..
Cu toate acestea, producția de detergenți îmbogățiți cu fosfați a fost redusă datorită eutrofizării lacurilor și râurilor și, odată cu aceasta, a proliferării algelor care le acoperă suprafețele..
De asemenea, a fost folosit pentru fabricarea unui dezinfectant: Na3PO41 / 4NaOCl11HDouăSau, care este preparat folosind hipoclorit de sodiu, NaOCl, în loc de NaOH sau NaDouăCO3 pentru a neutraliza H3PO4.
Medicinal
Apoi o3PO4 induce defecația acționând ca un laxativ hiperosmotic, necesar pentru curățarea colonului înainte ca pacientul să fie supus unei colonoscopii. Pe de altă parte, a fost de asemenea utilizat (adăugat) în suplimentele energetice.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Fosfat trisodic. Baza de date PubChem. CID = 24243. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Fosfat trisodic. Recuperat de pe: en.wikipedia.org
- Curran M.P. & Plosker G.L. (2004). Soluție orală de fosfat de sodiu: o revizuire a utilizării sale ca demachiant colorectal. DOI: 10.2165 / 00003495-200464150-00009
- Corey Whelan. (22 decembrie 2017). Fosfat de sodiu. Recuperat de pe: healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Procedeu de producere a fosfatului trisodic. Recuperat de pe: freepatentsonline.com
- MaryAnn Marks. (2018). De ce se adaugă fosfat de trisodiu (TSP) la mâncarea noastră? Recuperat de pe: theingredientguru.com



Nimeni nu a comentat acest articol încă.