
Tipuri, procese și funcții de glicozilare a proteinelor

glicozilarea proteinelor Este o modificare post-translațională care constă în adăugarea de lanțuri oligozaharidice liniare sau ramificate la o proteină. Glicoproteinele rezultate sunt în general proteine de suprafață și proteine de cale secretorie..
Glicozilarea este una dintre cele mai frecvente modificări peptidice în rândul organismelor eucariote, dar s-a dovedit că apare și în unele specii de arhee și bacterii..
La eucariote, acest mecanism apare între reticulul endoplasmatic (ER) și complexul Golgi, cu intervenția diferitelor enzime implicate atât în procesele de reglare, cât și în formarea legăturilor covalente proteină + oligozaharide..
Indice articol
- 1 Tipuri de glicoliză
- 1.1 N-glicozilarea
- 1.2 O-glicozilarea
- 1.3 C-manozilare
- 1.4 Glypiation (din engleză "Glypiation")
- 2 Proces
- 2.1 În eucariote
- 2.2 La procariote
- 3 Funcții
- 3.1 Importanța
- 4 Referințe
Tipuri de glicoliză
În funcție de locul de legare al oligozaharidei la proteină, glicozilarea poate fi clasificată în 4 tipuri:
N-glicozilarea
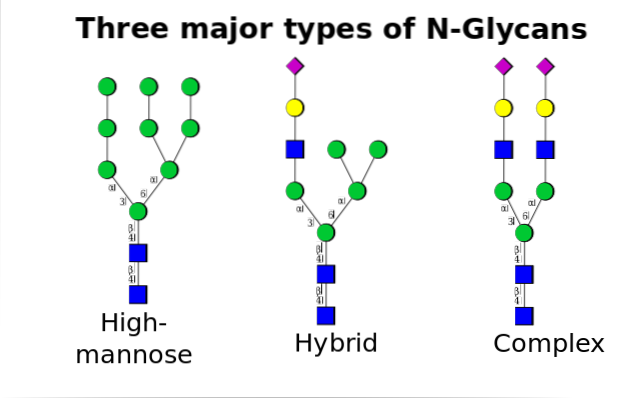
Este cel mai comun dintre toate și apare atunci când oligozaharidele se leagă de azotul grupului amidic al reziduurilor de asparagină din motivul Asn-X-Ser / Thr, unde X poate fi orice aminoacid, cu excepția prolinei..
SAU-glicozilarea
Când carbohidrații sunt atașați la grupul hidroxil al serinei, treoninei, hidroxilizinei sau tirozinei. Este o modificare mai puțin frecventă și sunt exemple de proteine precum colagenul, glicoforina și mucinele..
C-manozilatie
Acesta constă în adăugarea unui reziduu de manoză care se leagă de proteină printr-o legătură C-C cu C2 a grupării indol în reziduuri de triptofan.
Glipiation (din engleza „Glifiere ")
O polizaharidă acționează ca o punte pentru a atașa o proteină la o ancoră glicozilfosfatidilinozitol (GPI) de pe membrană.
Proces
În eucariote
N-glicozilarea este cea care a fost studiată mai detaliat. În celulele mamiferelor, procesul începe în ER dură, unde o polizaharidă preformată se leagă de proteine pe măsură ce acestea ies din ribozomi..
Precursorul respectiv polizaharidă este compus din 14 reziduuri de zahăr, și anume: 3 glucoză (Glc), 9 manoză (Man) și 2 reziduuri de N-acetil glucozamină (GlcNAc).
Acest precursor este comun la plante, animale și la organismele eucariote unicelulare. Este legat de membrană datorită unei legături cu o moleculă de dolichol, o lipidă izoprenoidă încorporată în membrana ER..
După sinteza sa, oligozaharida este transferată de complexul enzimatic oligosacrililtransferază la un reziduu de asparagină inclus în secvența tri-peptidică Asn-X-Ser / Thr a unei proteine în timp ce este tradusă.
Cele trei reziduuri de Glc de la sfârșitul oligozaharidei servesc drept semnal pentru sinteza corectă a oligozaharidelor și sunt clivate împreună cu unul dintre resturile Man înainte ca proteina să fie transportată în aparatul Golgi pentru prelucrare ulterioară..
Odată ajuns în aparatul Golgi, porțiunile de oligozaharide atașate glicoproteinelor pot fi modificate prin adăugarea de galactoză, acid sialic, fucoză și multe alte reziduuri, producând lanțuri cu o varietate și complexitate mult mai mari..
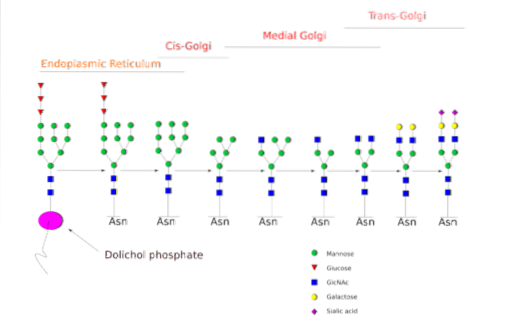
Mașinile enzimatice necesare pentru efectuarea proceselor de glicozilare includ numeroase glicoziltransferaze pentru adăugarea de zaharuri, glicozidaze pentru îndepărtarea lor și diferiți transportori de zahăr nucleotidici pentru contribuția reziduurilor utilizate ca substraturi..
La procariote
Bacteriile nu au sisteme de membrană intracelulară, astfel încât formarea oligozaharidei inițiale (de doar 7 reziduuri) are loc pe latura citosolică a membranei plasmatice..
Precursorul menționat este sintetizat pe o lipidă care este apoi translocată de o flipază dependentă de ATP în spațiul periplasmatic, unde are loc glicozilarea..
O altă diferență importantă între glicozilarea eucariotă și procariotă este că enzima oligozaharid transferază (oligozahariltransferaza) de la bacterii poate transfera reziduurile de zahăr în porțiuni libere de proteine deja pliate, nu așa cum sunt traduse de ribozomi..
Mai mult, motivul peptidic recunoscut de această enzimă nu este aceeași secvență eucariotă tri-peptidică..
Caracteristici
N-oligozaharidele atașate glicoproteinelor au diverse scopuri. De exemplu, unele proteine necesită această modificare post-translațională pentru a realiza plierea corectă a structurii lor..
Pentru alții, asigură stabilitate, fie prin evitarea degradării proteolitice, fie pentru că această porțiune este necesară pentru a-și îndeplini funcția biologică..
Deoarece oligozaharidele au un puternic caracter hidrofil, adăugarea lor covalentă la o proteină modifică în mod necesar polaritatea și solubilitatea acesteia, care poate avea relevanță din punct de vedere funcțional..
Odată atașate la proteinele de membrană, oligozaharidele sunt purtători de informații valoroși. Aceștia participă la procesele de semnalizare, comunicare, recunoaștere, migrare și adeziune celulară.
Acestea au un rol important în coagularea sângelui, vindecarea și răspunsul imun, precum și în procesarea controlului calității proteinelor, care este dependent de glican și indispensabil celulei..
Importanţă
Cel puțin 18 boli genetice au fost legate de glicozilarea proteinelor la om, dintre care unele implică o dezvoltare fizică și mentală slabă, în timp ce altele pot fi fatale.
Există un număr tot mai mare de descoperiri legate de bolile de glicozilare, în special la copii și adolescenți. Multe dintre aceste tulburări sunt congenitale și au de-a face cu defecte asociate cu etapele inițiale de formare a oligozaharidelor sau cu reglarea enzimelor care participă la aceste procese..
Deoarece o mare parte a proteinelor glicozilate alcătuiesc glicocalixul, există un interes din ce în ce mai mare în verificarea faptului că mutațiile sau modificările proceselor de glicozilare pot fi legate de schimbarea microambientului celulelor tumorale și astfel promovează progresia tumorilor și dezvoltarea metastaze la bolnavii de cancer.
Referințe
- Aebi, M. (2013). Glicozilarea proteinei N-legată în ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M. și Warren, C. E. (1999). Glicozilarea proteinelor în dezvoltare și boală. BioEssays, douăzeci și unu(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., ... Martin, K. (2003). Biologie celulară moleculară (Ed. A 5-a). Freeman, W. H. & Company.
- Luckey, M. (2008). Biologia structurală a membranei: cu fundații biochimice și biofizice. Cambridge University Press. Adus de pe www.cambrudge.org/9780521856553
- Nelson, D. L. și Cox, M. M. (2009). Principiile Lehninger de biochimie. Ediții Omega (Ediția a 5-a).
- Nothaft, H. și Szymanski, C. M. (2010). Glicozilarea proteinelor în bacterii: mai dulce ca niciodată. Nature Review Microbiology, 8(11), 765-778.
- Ohtsubo, K. și Marth, J. D. (2006). Glicozilarea în mecanismele celulare de sănătate și boală. Celula, 126(5), 855-867.
- Spiro, R. G. (2002). Glicozilarea proteinelor: natura, distribuția, formarea enzimatică și implicațiile bolii legăturilor glicopeptidice. Glicobiologie, 12(4), 43R-53R.
- Stowell, S. R., Ju, T. și Cummings, R. D. (2015). Glicozilarea proteinelor în cancer. Revizuirea anuală a patologiei: mecanisme de boală, 10(1), 473-510.
- Strasser, R. (2016). Glicozilarea proteinelor vegetale. Glicobiologie, 26(9), 926-939.
- Xu, C. și Ng, D. T. W. (2015). Controlul calității îndreptat către glicozilare a plierii proteinelor. Nature Review Biologie celulară moleculară, 16(12), 742-752.
- Zhang, X. și Wang, Y. (2016). Controlul calității glicozilării de către structura Golgi. Jurnalul de biologie moleculară, 428(16), 3183-3193.



Nimeni nu a comentat acest articol încă.