
Proprietăți, structură și utilizări ale acidului sulfuric (H2SO4)
acid sulfuric (HDouăSW4) Este un compus chimic lichid, uleios și incolor, solubil în apă cu eliberare de căldură și coroziv pentru metale și țesături. Carbonizează lemnul și majoritatea materiei organice la contactul cu acesta, dar este puțin probabil să provoace un incendiu.
Acidul sulfuric este probabil cel mai important dintre toate produsele chimice industriale grele și consumul său a fost citat de multe ori ca indicator al stării generale a economiei unei națiuni..

Expunerea pe termen lung la concentrații scăzute sau expunerea pe termen scurt la concentrații mari poate duce la efecte adverse asupra sănătății. De departe cea mai importantă utilizare a acidului sulfuric este în industria îngrășămintelor fosfatice.
Alte aplicații importante sunt în rafinarea petrolului, producția de pigmenți, decaparea oțelului, extracția metalelor neferoase și fabricarea de explozivi, detergenți, materiale plastice, fibre artificiale și produse farmaceutice..
Indice articol
- 1 Vitriolul, antecedentul acidului sulfuric
- 2 Formula
- 3 Structura chimică
- 3.1 În 2D
- 3.2 În 3D
- 4 caracteristici
- 4.1 Proprietăți fizice și chimice
- 4.2 Reacții cu aerul și apa
- 4.3 Inflamabilitate
- 4.4 Reactivitate
- 4.5 Toxicitate
- 5 utilizări
- 5.1 Indirect
- 5.2 Direct
- 6 Dezvoltarea industriei acidului sulfuric
- 6.1 Procesul Vitriol
- 6.2 Camere de plumb
- 7 Producția actuală: procesul de contact
- 7.1 Proces dublu contact
- 8 Materii prime utilizate la producerea acidului sulfuric
- 8.1 Pirita
- 8.2 Dioxid de sulf
- 8.3 Reciclat
- 9 Efecte clinice
- 10 Siguranță și riscuri
- 10.1 Clasele de pericol GHS
- 10.2 Coduri de declarații de precauție
- 11 Referințe
Vitriolul, antecedentul acidului sulfuric
În Europa medievală, acidul sulfuric era cunoscut sub denumirea de alchimiști sub denumirea de vitriol, ulei de vitriol sau lichior de vitriol. A fost considerată cea mai importantă substanță chimică și s-a încercat să fie folosită ca piatră filosofică.
Sumerienii aveau deja o listă cu diferite tipuri de vitriol. În plus, Galen, medicul grec Dioscoride și Pliniu cel Bătrân și-au ridicat utilizarea medicală.

În lucrările alchimice elenistice au fost deja menționate utilizările metalurgice ale substanțelor vitriolice. Vitriolul este un grup de minerale vitroase din care se poate obține acid sulfuric.
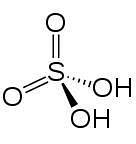
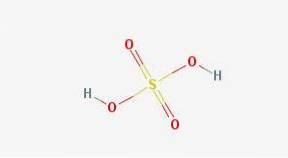
Formulă
-Formulă: HDouăSW4
-Numar CAS: 7664-93-9
Structura chimică
În 2D
În 3d
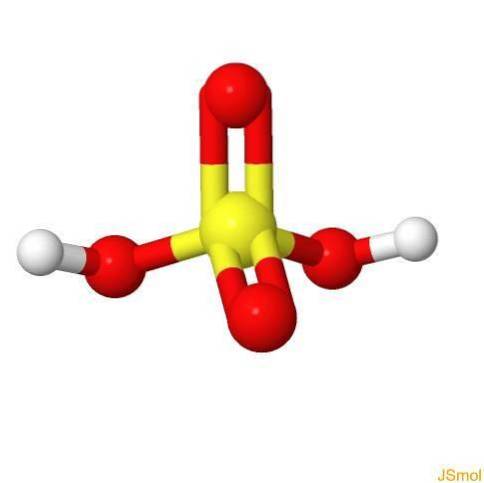
Caracteristici
Proprietati fizice si chimice

Acidul sulfuric aparține grupului reactiv al acizilor oxidanți puternici.
Reacții cu aerul și apa
- Reacția cu apa este neglijabilă, cu excepția cazului în care aciditatea este peste 80-90%, atunci căldura hidrolizei este extremă, poate provoca arsuri severe.
Inflamabilitate
- Acizii oxidanți puternici sunt în general neinflamabili. Pot accelera arderea altor materiale prin furnizarea de oxigen la locul de ardere.
- Cu toate acestea, acidul sulfuric este foarte reactiv și este capabil să aprindă materiale combustibile fin divizate atunci când este în contact cu acestea..
- Când este încălzit, emite vapori foarte toxici.
- Este exploziv sau incompatibil cu o mare varietate de substanțe.
- Poate suferi modificări chimice violente la temperaturi și presiuni ridicate.
- Poate reacționa violent cu apă.
Reactivitate
- Acidul sulfuric este puternic acid.
- Reacționează violent cu pentafluorură de brom.
- Explodați cu para-nitrotoluen la 80 ° C.
- O explozie apare atunci când acidul sulfuric concentrat este amestecat cu permanganat de potasiu cristalin într-un recipient care conține umiditate. Se formează heptoxid de mangan, care explodează la 70 ° C.
- Amestecul de acrilonitril cu acid sulfuric concentrat trebuie păstrat bine refrigerat, altfel apare o reacție exotermă viguroasă.
- Temperatura și presiunea cresc atunci când acidul sulfuric (96%) este amestecat în porțiuni egale într-un recipient închis cu oricare dintre următoarele substanțe: acetonitril, acroleină, 2-aminoetanol, hidroxid de amoniu (28%), anilină, n-butiraldehidă, clorosulfonică acid, etilen diamină, etilenimină, epiclorhidrină, etilen cianohidrin, acid clorhidric (36%), acid fluorhidric (48,7%), oxid de propilenă, hidroxid de sodiu, monomer de stiren.
- Acidul sulfuric (concentrat) este extrem de periculos în contact cu carburi, bromați, clorați, grunduri, picrați și metale praf..
- Poate induce polimerizarea violentă a clorurii de alil și reacționează exoterm cu hipocloritul de sodiu pentru a produce clor gazos.
- Amestecând acid clorosulfuric și 98% acid sulfuric se obține HCI.
Toxicitate
- Acidul sulfuric este coroziv pentru toate țesuturile din corp. Inhalarea vaporilor poate provoca leziuni pulmonare grave. Contactul cu ochii poate duce la pierderea totală a vederii. Contactul cu pielea poate provoca necroze severe.
- Înghițirea acidului sulfuric, într-o cantitate cuprinsă între 1 linguriță și jumătate de uncie de substanță chimică concentrată, poate fi fatală pentru un adult. Chiar și câteva picături pot fi fatale dacă acidul pătrunde în trahee.
- Expunerea cronică poate provoca traheobronșită, stomatită, conjunctivită și gastrită. Pot apărea perforații gastrice și peritonite și pot fi urmate de colaps circulator. Șocul circulator este adesea cauza imediată a decesului.
- Cei cu boli cronice respiratorii, gastrointestinale sau nervoase și orice boli ale ochilor și ale pielii prezintă un risc crescut.
Aplicații
- Acidul sulfuric este una dintre cele mai utilizate substanțe chimice industriale din lume. Dar, majoritatea utilizărilor sale pot fi considerate indirecte, participând mai degrabă ca reactiv decât ca ingredient.
- Majoritatea acidului sulfuric ajunge ca acid cheltuit în producerea altor compuși sau ca un fel de reziduu de sulfat.
- O serie de produse încorporează sulf sau acid sulfuric, dar aproape toate sunt produse speciale cu volum redus..
- Aproximativ 19% din acidul sulfuric produs în 2014 a fost consumat în aproximativ douăzeci de procese chimice, iar restul a fost consumat într-o mare varietate de aplicații industriale și tehnice.
- Creșterea cererii de acid sulfuric la nivel mondial se datorează, în ordine descrescătoare, producției de: acid fosforic, dioxid de titan, acid fluorhidric, sulfat de amoniu și în procesarea uraniului și aplicații metalurgice.
Indirect
- Cel mai mare consumator de acid sulfuric este de departe industria îngrășămintelor. A reprezentat puțin peste 58% din consumul mondial total în 2014. Cu toate acestea, se preconizează că această proporție va scădea la aproximativ 56% până în 2019, în principal ca urmare a creșterii mai mari în alte aplicații chimice și industriale..
- Producția de materiale de îngrășământ fosfat, în special acid fosforic, este piața principală a acidului sulfuric. Este, de asemenea, utilizat pentru fabricarea de îngrășăminte precum superfosfatul triplu și fosfații mono și diamoniu. Cantități mai mici sunt utilizate pentru producerea superfosfatului și a sulfatului de amoniu.
- În alte aplicații industriale, cantități substanțiale de acid sulfuric sunt utilizate ca mediu de reacție de deshidratare acidă, în chimia organică și în procesele petrochimice care implică reacții precum nitrarea, condensarea și deshidratarea, precum și în rafinarea petrolului., Unde este utilizat în rafinarea, alchilarea și purificarea distilatelor brute.
- În industria chimică anorganică, utilizarea sa este remarcabilă în producția de pigmenți TiO2, acid clorhidric și acid fluorhidric..
- În industria de prelucrare a metalelor, acidul sulfuric este utilizat pentru decaparea oțelului, leșierea minereurilor de cupru, uraniu și vanadiu în prelucrarea hidrometalurgică a mineralelor și în prepararea băilor electrolitice pentru purificarea și placarea metalelor. feroase.
- Anumite procese de fabricare a pastei de lemn în industria hârtiei, în producția unor textile, în fabricarea fibrelor chimice și în tăbăcirea pieilor necesită, de asemenea, acid sulfuric.
Direct
- Probabil cea mai mare utilizare a acidului sulfuric, în care sulful este încorporat în produsul final, este în procesul de sulfonare organică, în special pentru producția de detergenți..
- Sulfonarea joacă, de asemenea, un rol important în obținerea altor produse chimice organice și produse farmaceutice minore..
- Bateriile cu plumb sunt unul dintre cele mai cunoscute produse de consum care conțin acid sulfuric, reprezentând doar o mică parte din consumul total de acid sulfuric..
- În anumite condiții, acidul sulfuric este utilizat direct în agricultură pentru reabilitarea solurilor foarte alcaline, cum ar fi cele găsite în regiunile deșertice din vestul Statelor Unite. Cu toate acestea, această utilizare nu este foarte importantă în ceea ce privește volumul total de acid sulfuric utilizat..
Dezvoltarea industriei acidului sulfuric
Procesul Vitriol

Cea mai veche metodă de obținere a acidului sulfuric este așa-numitul „proces vitriol”, care se bazează pe descompunerea termică a vitriolilor, care sunt sulfați de diferite tipuri, de origine naturală..
Alchimiștii persani, Jābir ibn Hayyān (cunoscut și sub numele de Geber, 721-815 d.Hr.), Razi (865 - 925 d.Hr.) și Jamal Din al-Watwat (1318 d.Hr.), au inclus vitriolul în listele lor de clasificare a mineralelor.
Prima mențiune a „procesului vitriol” apare în scrierile lui Jabir ibn Hayyan. Apoi alchimiștii Sfântul Albert cel Mare și Basilius Valentinus au descris procesul mai detaliat. Ca materie primă s-a folosit alum și calcantit (vitriol albastru).
La sfârșitul Evului Mediu, acidul sulfuric a fost obținut în cantități mici în recipiente de sticlă, în care sulful a fost ars cu săpetar într-un mediu umed..
Procesul vitriol a fost utilizat la scară industrială din secolul al XVI-lea datorită unei cereri mai mari de acid sulfuric.
Vitriolul din Nordhausen
Centrul de producție a fost în orașul german Nordhausen (motiv pentru care vitriolul a început să fie numit „Nordhausen vitriol”), unde sulfatul de fier (II) (vitriolul verde, FeSO4 - 7HDouăO) ca materie primă, care a fost încălzită, iar trioxidul de sulf rezultat a fost amestecat cu apă pentru a obține acid sulfuric (ulei de vitriol).
Procesul a fost efectuat în bucătării, dintre care unele au avut mai multe niveluri, în paralel, pentru a obține cantități mai mari de ulei de vitriol..
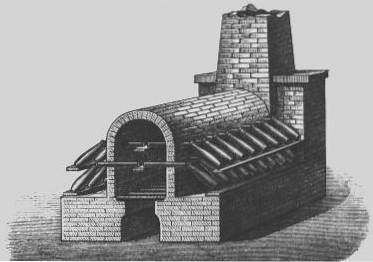
Camere de conducere
În secolul al XVIII-lea, a fost dezvoltat un proces mai economic pentru producerea acidului sulfuric, cunoscut sub numele de „procesul cu cameră de plumb”..
Până atunci, concentrația maximă de acid obținută era de 78%, în timp ce cu „procesul vitriol” se obținea acid concentrat și oleum, astfel această metodă a continuat să fie utilizată în anumite sectoare ale industriei până la apariția „procesului de contact” în 1870, cu care acidul concentrat putea fi obținut mai ieftin.
Oleumul sau acidul sulfuric fumant (CAS: 8014-95-7), este o soluție de consistență uleioasă și culoare maro închis, cu o compoziție variabilă de trioxid de sulf și acid sulfuric, care poate fi descrisă prin formula HDouăSW4.xSO3 (unde x reprezintă conținutul molar liber al oxidului de sulf (VI)). O valoare pentru x de 1 dă formula empirică HDouăSDouăSAU7, corespunzător acidului disulfuric (sau acidului pirosulfuric).
Proces
Procesul camerei de plumb a fost metoda industrială utilizată pentru a produce acid sulfuric în cantități mari, înainte de a fi înlocuit de „procesul de contact”.
În 1746, la Birmingham, Anglia, John Roebuck a început să producă acid sulfuric în camere căptușite cu plumb, care erau mai puternice și mai puțin costisitoare decât recipientele din sticlă utilizate anterior și puteau fi făcute mult mai mari.
Dioxidul de sulf (din arderea sulfului elementar sau a mineralelor metalice care conțin sulf, cum ar fi pirita) a fost introdus cu abur și oxid de azot în camere mari căptușite cu foi de plumb..
Dioxidul de sulf și dioxidul de azot s-au dizolvat și, pe o perioadă de aproximativ 30 de minute, dioxidul de sulf a fost oxidat în acid sulfuric..
Acest lucru a permis industrializarea eficientă a producției de acid sulfuric și, cu diverse rafinări, acest proces a rămas metoda standard de producție timp de aproape două secole..
În 1793, Clemente și Desormes au obținut rezultate mai bune prin introducerea aerului suplimentar în procesul camerei de plumb..
În 1827, Gay-Lussac a introdus o metodă de absorbție a oxizilor de azot din gazele reziduale din camera de plumb..
În 1859, Glover a dezvoltat o metodă de recuperare a oxizilor de azot din acidul nou format, prin stripare cu gaze fierbinți, ceea ce a făcut posibilă desfășurarea continuă a procesului de catalizare a oxidului de azot..
În 1923, Petersen a introdus un proces de turn îmbunătățit care i-a permis să fie competitiv cu procesul de contact până în anii 1950..
Procesul camerei a devenit atât de robust încât în 1946 a reprezentat încă 25% din producția mondială de acid sulfuric..
Producția actuală: procesul de contact
Procesul de contact este metoda actuală de producere a acidului sulfuric în concentrații mari, necesară în procesele industriale moderne. Platina a fost catalizatorul acestei reacții. Cu toate acestea, pentoxidul de vanadiu (V2O5) este acum preferat.
În 1831, în Bristol, Anglia, Peregrine Phillips a brevetat oxidarea dioxidului de sulf în trioxid de sulf folosind un catalizator de platină la temperaturi ridicate..
Cu toate acestea, adoptarea invenției sale și dezvoltarea intensă a procesului de contact, au început numai după ce cererea de oleum pentru fabricarea colorantului a crescut de la aproximativ 1872 încoace..
Apoi, s-au căutat catalizatori solizi mai buni și s-au investigat chimia și termodinamica echilibrului SO2 / SO3..
Procesul de contact poate fi împărțit în cinci etape:
- Combinație de sulf și dioxigen (O2) pentru a forma dioxid de sulf.
- Purificarea dioxidului de sulf într-o unitate de purificare.
- Adăugarea de dioxigen în exces la dioxidul de sulf în prezența catalizatorului de pentoxid de vanadiu, la temperaturi de 450 ° C și presiune de 1-2 atm.
- Trioxidul de sulf format se adaugă la acidul sulfuric dând naștere la oleum (acid disulfuric).
- Oleul este apoi adăugat în apă pentru a forma acid sulfuric care este foarte concentrat..
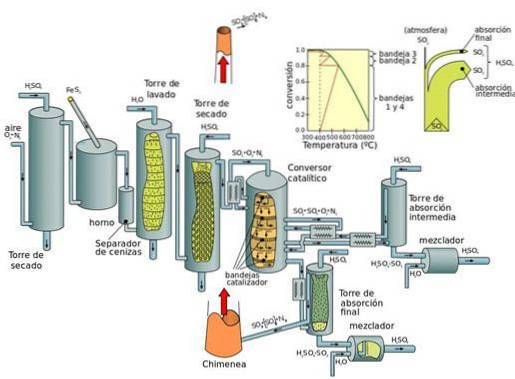
Dezavantajul fundamental al proceselor de oxid de azot (în timpul procesului camerei de plumb) este că concentrația de acid sulfuric obținută este limitată la maximum 70 până la 75%, în timp ce procesul de contact produce acid concentrat (98%).
Odată cu dezvoltarea unor catalizatori de vanadiu relativ ieftini pentru procesul de contact, împreună cu cererea crescândă de acid sulfuric concentrat, producția globală de acid sulfuric în instalațiile de procesare a oxidului de azot a scăzut constant..
Până în 1980, practic nu se producea acid în fabricile de procesare a oxidului de azot din Europa de Vest și America de Nord.
Proces dublu contact
Procesul de dublu contact cu dublă absorbție (DCDA sau Double Contact Double Absorption) a introdus îmbunătățiri în procesul de contact pentru producerea de acid sulfuric.
În 1960, Bayer a solicitat un brevet pentru așa-numitul proces de dublă cataliză. Prima fabrică care a folosit acest proces a fost începută în 1964.
Prin încorporarea unei etape de absorbție a SO3 Înainte de etapele finale catalitice, procesul de contact îmbunătățit a permis o creștere semnificativă a conversiei SO.Două , reducându-și substanțial emisiile în atmosferă.
Gazele sunt trecute înapoi prin coloana finală de absorbție, obținând nu numai o performanță ridicată de conversie a SODouă la SO3 (de aproximativ 99,8%), dar permițând și producerea unei concentrații mai mari de acid sulfuric.
Diferența esențială dintre acest proces și procesul obișnuit de contact constă în numărul de etape de absorbție..
Începând cu anii 1970, principalele țări industriale au introdus reglementări mai stricte pentru protecția mediului, iar procesul de preluare dublă a devenit mai răspândit în noile uzine. Cu toate acestea, procesul de contact convențional este încă utilizat în multe țări în curs de dezvoltare cu standarde de mediu mai puțin stricte..
Cel mai mare impuls pentru dezvoltarea actuală a procesului de contact se concentrează pe creșterea recuperării și utilizării cantității mari de energie produsă în proces..
De fapt, o mare instalație modernă de acid sulfuric poate fi privită nu numai ca o instalație chimică, ci și ca o centrală termică..
Materii prime utilizate la producerea acidului sulfuric
Pirita
Pirita a fost materia primă dominantă în producția de acid sulfuric până la mijlocul secolului al XX-lea, când cantități mari de sulf elementar au început să fie recuperate din procesul de rafinare a petrolului și de la purificarea gazelor naturale, devenind principala primă din industria materialelor..
Dioxid de sulf
În prezent, dioxidul de sulf se obține prin diferite metode, din diverse materii prime.
În Statele Unite, industria se bazează încă din primii ani ai secolului XX pe obținerea de sulf elementar din zăcăminte subterane prin „Procesul Frasch”.
Acidul sulfuric moderat concentrat este produs și prin reconcentrare și purificare a unor cantități mari de acid sulfuric obținute ca subprodus al altor procese industriale..
Reciclarea
Reciclarea acestui acid este din ce în ce mai importantă din punct de vedere al mediului, în special în principalele țări dezvoltate..
Fabricarea acidului sulfuric pe bază de sulf elementar și pirită este, desigur, relativ sensibilă la condițiile pieței, deoarece acidul produs din aceste materiale reprezintă un produs primar..
În schimb, atunci când acidul sulfuric este un produs secundar, fabricat ca mijloc de îndepărtare a deșeurilor dintr-un alt proces, nivelul producției sale nu este dictat de condițiile de pe piața acidului sulfuric, ci de condițiile pieței pentru produsul primar.
Efecte clinice
-Acidul sulfuric este utilizat în industrie și în unele produse de curățare de uz casnic, cum ar fi produsele de curățat pentru baie. De asemenea, utilizat în baterii.
-Ingerarea deliberată, în special a produselor foarte concentrate, poate provoca răniri grave și deces. Aceste expuneri la ingestie sunt rare în Statele Unite, dar sunt răspândite în alte părți ale lumii..
-Este un acid puternic care provoacă leziuni tisulare și coagulare a proteinelor. Este coroziv pentru piele, ochi, nas, membrane mucoase, tractul respirator și tractul gastro-intestinal sau orice țesut cu care intră în contact..
-Gravitatea leziunii este determinată de concentrația și durata contactului.
-Expuneri mai ușoare (concentrații mai mici de 10%) provoacă doar iritații ale pielii, ale căilor respiratorii superioare și ale mucoasei gastro-intestinale.
-Efectele respiratorii ale expunerii acute la inhalare includ: iritarea nasului și gâtului, tuse, strănut, bronhospasm reflex, dispnee și edem pulmonar. Moartea poate apărea din cauza colapsului circulator brusc, a edemului glotei și a afectării căilor respiratorii sau a leziunilor pulmonare acute.
-Ingerarea acidului sulfuric poate provoca dureri epigastrice imediate, greață, salivație și vărsături de material mucoid sau hemoragic care arată ca „zaț de cafea”. Ocazional se observă vărsături de sânge proaspăt.
-Ingerarea acidului sulfuric concentrat poate duce la coroziunea esofagului, necroză și perforarea esofagului sau a stomacului, în special în pilor. Ocazional, se observă leziuni ale intestinului subțire. Complicațiile ulterioare pot include stenoza și formarea fistulei. După ingestie, se poate dezvolta acidoză metabolică.
-Pot apărea arsuri severe ale pielii cu necroză și cicatrici. Acestea pot fi fatale dacă este afectată o suprafață suficient de mare a suprafeței corpului..
-Ochiul este deosebit de sensibil la rănirea prin coroziune. Iritarea, ruperea și conjunctivita se pot dezvolta chiar și cu concentrații scăzute de acid sulfuric. Stropirile cu acid sulfuric în concentrații mari determină: arsuri ale corneei, pierderea vederii și ocazional perforarea globului.
-Expunerea cronică poate fi asociată cu modificări ale funcției pulmonare, bronșită cronică, conjunctivită, emfizem, infecții respiratorii frecvente, gastrită, eroziune a smalțului dinților și, eventual, cancer al tractului respirator..
Siguranță și riscuri
Declarații de pericol ale Sistemului global armonizat de clasificare și etichetare a substanțelor chimice (GHS)
Sistemul global de armonizare a clasificării și etichetării substanțelor chimice (GHS) este un sistem agreat la nivel internațional, creat de Organizația Națiunilor Unite conceput pentru a înlocui diferitele standarde de clasificare și etichetare utilizate în diferite țări prin utilizarea unor criterii consistente la nivel global (Nations United, 2015 ).
Clasele de pericol (și capitolul corespunzător al GHS), standardele de clasificare și etichetare și recomandările pentru acidul sulfuric sunt următoarele (Agenția Europeană pentru Produse Chimice, 2017; Națiunile Unite, 2015; PubChem, 2017):
Clasele de pericol GHS
H303: Poate fi dăunător în caz de înghițire [Avertisment Toxicitate acută, orală - Categoria 5] (PubChem, 2017).
H314: Provoacă arsuri grave ale pielii și leziuni oculare [Pericol Coroziune / iritare a pielii - Categoria 1A, B, C] (PubChem, 2017).
H318: Provoacă leziuni oculare grave [Pericol Leziuni oculare grave / iritarea ochilor - Categoria 1] (PubChem, 2017).
H330: Fatal prin inhalare [Pericol Toxicitate acută, inhalare - Categoria 1, 2] (PubChem, 2017).
H370: Provoacă daune organelor [Toxicitate specifică organelor țintă periculoase, expunere unică - Categoria 1] (PubChem, 2017).
H372: Provoacă leziuni ale organelor prin expunere prelungită sau repetată [Pericol Toxicitate specifică a organelor țintă, expunere repetată - Categoria 1] (PubChem, 2017).
H402: Nociv pentru viața acvatică [Periculos pentru mediul acvatic, pericol acut - Categoria 3] (PubChem, 2017).
Coduri de declarații de precauție
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P320, P320 P363, P403 + P233, P405 și P501 (PubChem, 2017).
Referințe
- Arribas, H. (2012) Diagrama producției de acid sulfuric prin metoda de contact folosind pirita ca materie primă [imagine] Recuperat de pe wikipedia.org.
- Manual de economie chimică, (2017). Acid sulfuric. Recuperat de pe ihs.com.
- Chemical Economics Handbook, (2017.) Consumul mondial de acid sulfuric - 2013 [imagine]. Recuperat de pe ihs.com.
- ChemIDplus, (2017). Structura 3D a 7664-93-9 - Acid sulfuric [imagine] Recuperat de la: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Portretul „Geber” din secolul al XV-lea. Biblioteca Laurenziana Medicea [imagine]. Recuperat de pe wikipedia.org.
- Agenția Europeană pentru Produse Chimice (ECHA), (2017). Rezumatul clasificării și etichetării. Clasificare armonizată - Anexa VI la Regulamentul (CE) nr. 1272/2008 (Regulamentul CLP).
- Banca de date privind substanțele periculoase (HSDB). TOXNET. (2017). Acid sulfuric. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: toxnet.nlm.nih.gov.
- Leyo (2007) Formula scheletică a acidului sulfuric [imagine]. Recuperat de pe: commons.wikimedia.org.
- Compania Liebig's Extract of Meat (1929) Albertus Magnus, Chimistes Celebres [imagine]. Recuperat de pe: wikipedia.org.
- Müller, H. (2000). Acid sulfuric și trioxid de sulf. În Enciclopedia lui Ullmann de chimie industrială. Wiley-VCH Verlag GmbH & Co. KGaA. Disponibil la: doi.org.
- Națiunile Unite (2015). Sistemul armonizat global de clasificare și etichetare a substanțelor chimice (GHS) a șasea ediție revizuită. New York, UE: Publicația Națiunilor Unite. Recuperat de pe: unece.org.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date PubChem Compound, (2017). Acid sulfuric - Structura PubChem. [imagine] Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date PubChem Compound, (2017). Acid sulfuric. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Fișă tehnică chimică. Acid sulfuric, uzat. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Fișă tehnică chimică. Acid sulfuric. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Foaie de date a grupului reactiv. Acizi, oxidant puternic. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Oelen, W. (2011) Acid sulfuric 96% extra pur [imagine]. Recuperat de pe: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [image]. Recuperat de pe: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, în: Chemie in unserer Zeit. [imagine]. Recuperat de pe: wikipedia.org.
- Stephanb (2006) Sulfat de cupru [imagine]. Recuperat de pe: wikipedia.org.
- Stolz, D. (1614) Schema alchimică. Theatrum Chymicum [imagine] Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Acid sulfuric. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Acid sulfuric. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Procesul de contact. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Procesul camerei de plumb. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Oleum. Recuperat de pe: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Recuperat de pe: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Oxid de sulf Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Procesul Vitriol. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Dioxid de sulf. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Trioxid de sulf. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Acid sulfuric. Recuperat de pe: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Recuperat de pe: wikipedia.org.
- Wright, J. (1770) Alchimistul, în căutarea pietrei filosofale, descoperă fosforul și se roagă pentru încheierea cu succes a operației sale, așa cum era obiceiul astrologilor chimici antici. [imagine] Recuperat de pe: wikipedia.org.


Nimeni nu a comentat acest articol încă.