
Gravimetrie analiză gravimetrică, metode, utilizări și exemple
gravimetrie este una dintre ramurile principale ale chimiei analitice cuprinse dintr-o serie de tehnici a căror piatră de temelie comună este măsurarea masei. Masele pot fi măsurate în nenumărate moduri: direct sau indirect. Pentru a realiza astfel de măsurători esențiale scale; gravimetria este sinonimă cu masa și solzi.
Indiferent de ruta sau procedura selectată pentru obținerea maselor, semnalele sau rezultatele trebuie să facă întotdeauna lumină asupra concentrației analitului sau a speciilor de interes; în caz contrar, gravimetriei i-ar lipsi valoarea analitică. Acest lucru ar echivala cu afirmarea faptului că o echipă a lucrat fără un detector și era încă de încredere..

Imaginea de mai sus arată o scară veche, cu niște mere pe placa sa concavă.
Dacă masa merelor ar fi determinată cu această scală, am avea o valoare totală proporțională cu numărul de mere. Acum, dacă ar fi cântărite individual, fiecare valoare a masei ar corespunde particulelor totale ale fiecărui măr; proteinele, lipidele, zahărul, apa, cenușa etc..
În acest moment nu există indicii ale unei abordări gravimetrice. Dar să presupunem că balanța ar putea fi extrem de specifică și selectivă, neglijând ceilalți constituenți ai mărului în timp ce cântărește doar pe cel de interes..
Ajustând această scală idealizată, cântărirea mărului ar putea determina în mod direct cât din masa sa corespunde unui anumit tip de proteină sau grăsime; câtă apă stochează, cât cântăresc toți atomii săi de carbon etc. În acest fel ar fi determinant gravimetric compoziția nutrițională a mărului.
Din păcate, nu există o scală (cel puțin astăzi) care să poată face acest lucru. Cu toate acestea, există tehnici specifice care permit componentelor mărului să fie separate fizic sau chimic; și apoi și, în cele din urmă, cântăriți-le separat și construiți compoziția.
Indice articol
- 1 Ce este analiza gravimetrică?
- 1.1 -Tipuri de gravimetrie
- 1.2 -Precipitați
- 2 Metode de gravimetrie
- 2.1 Precipitații
- 2.2 Electrogravimetrie
- 2.3 Volatilizarea
- 2.4 Mecanice sau simple
- 2.5 Termogravimetrie
- 3 utilizări
- 4 Exemplu de analiză
- 4.1 Fosfiți
- 4.2 Plumb
- 4.3 Calciu
- 4.4 Nichel
- 5 Referințe
Ce este analiza gravimetrică?
Am descris exemplul merelor, când concentrația unui analit este determinată prin măsurarea unei mase, vorbim despre o analiză gravimetrică. Această analiză este cantitativă, deoarece răspunde la întrebarea „cât este acolo?” referitor la analit; dar el nu răspunde la aceasta măsurând volume sau radiații sau căldură, ci mase.
În viața reală probele nu sunt doar mere, ci practic orice tip de materie: gaz, lichid sau solid. Cu toate acestea, oricare ar fi starea fizică a acestor probe, trebuie să fie posibil să se extragă din ele o masă sau o diferență a acesteia care poate fi măsurată; care va fi direct proporțională cu concentrația analitului.
Când se spune că „extrage o masă” dintr-o probă, înseamnă a obține un precipitat, care constă dintr-un compus care conține analitul, adică el însuși.
Revenind la mere, pentru a măsura componentele și moleculele lor gravimetric, este necesar să se obțină un precipitat pentru fiecare dintre ele; un precipitat pentru apă, altul pentru proteine etc..
Odată ce toate sunt cântărite (după o serie de tehnici analitice și experimentale), se va ajunge la același rezultat ca cel al balanței idealizate..
-Tipuri de gravimetrie
În analiza gravimetrică există două modalități principale de determinare a concentrației analitului: direct sau indirect. Această clasificare este globală și din acestea derivă metode și tehnici specifice nesfârșite pentru fiecare analit din anumite eșantioane..
Direct
Analiza gravimetrică directă este una în care analitul este cuantificat prin măsurarea simplă a unei mase. De exemplu, dacă cântăriți un precipitat al unui compus AB și cunoașteți masele atomice ale lui A și B și masa moleculară a AB, puteți calcula masa lui A sau B separat..
Toate analizele care produc precipitate din ale căror mase se calculează masa analitului este gravimetrie directă. Separarea componentelor mărului în diferite precipitate este un alt exemplu al acestui tip de analiză..
Indirect
În analizele gravimetrice indirecte, se determină diferențele de masă. Aici se efectuează o scădere, care cuantifică analitul.
De exemplu, dacă mărul de pe cântar este cântărit mai întâi și apoi încălzit la sec (dar nu ars), toată apa se va vaporiza; adică mărul își va pierde tot conținutul de umiditate. Marul uscat se cântărește din nou, iar diferența de mase va fi egală cu masa de apă; prin urmare, apa a fost cuantificată gravimetric.
Dacă analiza ar fi simplă, ar trebui concepută o metodă ipotetică prin care toată apa ar putea fi scăzută din măr și cristalizată pe o scară separată pentru cântărire. Evident, metoda indirectă este cea mai ușoară și mai practică.
-Precipitat
Poate părea simplu la început să obțineți un precipitat, dar implică într-adevăr anumite condiții, procese, utilizarea agenților de mascare și a agenților de precipitare etc., pentru a-l putea separa de eșantion și că este în stare perfectă pentru a fi cântărit. ..
Caracteristici esențiale
Precipitatul trebuie să îndeplinească o serie de caracteristici. Unele dintre acestea sunt:
Puritate înaltă
Dacă nu ar fi suficient de pur, masele impurităților ar fi asumate ca parte a maselor analitului. Prin urmare, precipitatele trebuie purificate, fie prin spălare, recristalizare, fie prin orice altă tehnică..
Compoziție cunoscută
Să presupunem că precipitatul poate suferi următoarea descompunere:
MCO3(s) => MO (s) + CODouă(g)
Se întâmplă că nu se știe decât cât din MCO3 (carbonații metalici) s-a descompus în oxidul său respectiv. Prin urmare, compoziția precipitatului nu este cunoscută, deoarece ar putea fi un amestec OLS.3MO sau MCO33MO etc. Pentru a rezolva acest lucru, este necesar să se garanteze descompunerea completă a OLS3 la MO, cântărind numai MO.
Stabilitate
Dacă precipitatul este descompus de lumină ultravioletă, căldură sau prin contactul cu aerul, compoziția sa nu mai este cunoscută; și vă confruntați din nou cu situația anterioară.
Masă moleculară mare
Cu cât masa moleculară a precipitatului este mai mare, cu atât va fi mai ușor de cântărit, deoarece vor fi necesare cantități mai mici pentru a înregistra o citire a balanței..
Solubilitate redusă
Precipitatul trebuie să fie suficient de insolubil pentru a fi filtrat fără complicații majore..
Particule mari
Deși nu este strict necesar, precipitatul ar trebui să fie cât mai cristalin posibil; adică dimensiunea particulelor sale trebuie să fie cât mai mare posibil. Cu cât particulele sale sunt mai mici, cu atât devine mai gelatinoasă și coloidală și, prin urmare, necesită mai mult tratament: uscarea (îndepărtarea solventului) și calcinarea (făcând masa sa constantă).
Metode de gravimetrie
În gravimetrie există patru metode generale, care sunt menționate mai jos.
Precipitare
Menționate deja de-a lungul subsecțiunilor, acestea constau în precipitarea cantitativă a analitului pentru a-l determina. Proba este tratată fizic și chimic, astfel încât precipitatul să fie cât mai pur și adecvat posibil..
Electrogravimetrie
În această metodă, precipitatul este depus pe suprafața unui electrod prin care este trecut un curent electric în interiorul unei celule electrochimice..
Această metodă este utilizată pe scară largă în determinarea metalelor, deoarece acestea sunt depozitate, se calculează sărurile sau oxizii lor și, indirect, masele lor. Electrozii sunt mai întâi cântăriți înainte de a intra în contact cu soluția în care s-a dizolvat proba; apoi, se cântărește odată ce metalul este depus pe suprafața sa.
Volatilizare
În metodele de volatilizare gravimetrică, se determină masele de gaze. Aceste gaze provin dintr-o descompunere sau reacție chimică pe care o suferă proba, care sunt direct legate de analit..
Deoarece sunt gaze, este necesar să folosiți o capcană pentru a o colecta. Capcana, ca și electrozii, este cântărită înainte și după, calculând astfel indirect masa gazelor colectate..
Mecanice sau simple
Această metodă gravimetrică este în esență fizică: se bazează pe tehnici de separare a amestecului.
Prin utilizarea filtrelor, sitelor sau sitelor, sunt colectate solidele unei faze lichide și sunt cântărite direct pentru a determina compoziția lor solidă; de exemplu, procentul de argilă, deșeuri fecale, materiale plastice, nisip, insecte etc., într-un curent de apă.
Termogravimetrie
Această metodă constă, spre deosebire de celelalte, în caracterizarea stabilității termice a unui solid sau a unui material prin variațiile sale de masă în funcție de temperatură. O probă fierbinte poate fi practic cântărită cu o termobalanță, iar pierderea sa de masă este înregistrată pe măsură ce temperatura crește..
Aplicații
În termeni generali, sunt prezentate unele utilizări ale gravimetriei, indiferent de metodă și analiză:
-Separa diferite componente, solubile si insolubile, dintr-o proba.
-Efectuați o analiză cantitativă într-un timp mai scurt, atunci când nu este necesară construirea unei curbe de calibrare; masa este determinată și se știe imediat cât din analit este în probă.
-Nu numai că separă analitul, dar îl purifică și el.
-Determinați procentul de cenușă și umiditate solidă. La fel, cu o analiză gravimetrică, gradul său de puritate poate fi cuantificat (atâta timp cât masa substanțelor poluante nu este mai mică de 1 mg).
-Permite caracterizarea unui solid prin intermediul unei termograme.
-Manipularea solidelor și precipitatelor este de obicei mai simplă decât cea a volumelor, facilitând astfel anumite analize cantitative.
-În laboratoarele de predare, este utilizat pentru a evalua performanța elevilor în tehnicile de calcinare, cântărire și în utilizarea creuzetelor..
Exemplu de analiză
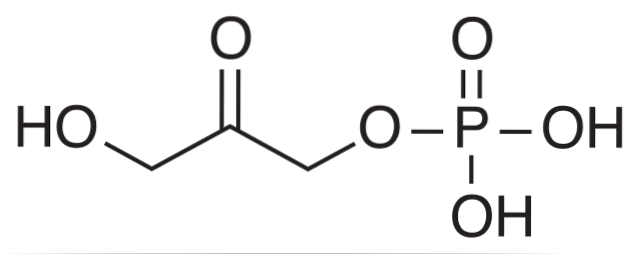
Fosfiți
O probă dizolvată în mediu apos poate fi determinată pentru fosfiții săi, PO33-, prin următoarea reacție:
2HgClDouă(ac) + PO33-(aq) + 3HDouăO (l) ⇌ HgDouăClDouă(s) + 2H3SAU+(aq) + 2CI-(ac) + 2PO43-(ac)
Rețineți că HgDouăClDouă precipită. Dacă se cântărește HgDouăClDouă iar molele sale sunt calculate, se poate calcula urmând stoichiometria reacției cât PO33- avut inițial. La soluția apoasă a probei se adaugă un exces de HgCl.Două pentru a se asigura că toate PO33- reacționează pentru a forma precipitatul.
Conduce
Dacă un mineral care conține plumb este digerat într-un mediu acid, de exemplu, ionii PbDouă+ poate depune ca PbODouă pe un electrod de platină folosind o tehnică electrogravimetrică. Reacția este:
PbDouă+(aq) + 4HDouăO (l) ⇌ PbODouă(s) + HDouă(g) + 2H3SAU+(ac)
Electrodul de platină este cântărit înainte și după și astfel se determină masa de PbO.Două, dintre care cu o factor gravimetric, se calculează masa de plumb.
Calciu
Calciul dintr-o probă poate fi precipitat prin adăugarea de acid oxalic și amoniac la soluția sa apoasă. În acest fel, anionul oxalat este generat încet și produce un precipitat mai bun. Reacțiile sunt:
2NH3(ac) + HDouăCDouăSAU4(ac) → 2NH4+(ac) + CDouăSAU4Două-(ac)
ACDouă+(ac) + CDouăSAU4Două-(ac) → CaCDouăSAU4(s)
Dar oxalatul de calciu este calcinat pentru a produce oxid de calciu, un precipitat cu o compoziție mai definită:
CaCDouăSAU4(s) → CaO (s) + CO (g) + CODouă(g)
Nichel
Și, în cele din urmă, concentrația de nichel a unei probe poate fi determinată gravimetric prin utilizarea dimetilglioximei (DMG): un agent organic de precipitare, cu care formează un chelat care precipită și are o culoare roșiatică caracteristică. DMG este generat la fața locului:
CH3COCCH3(aq) + 2NHDouăOH (aq) → DMG (aq) + 2HDouăO (l)
2DMG (ac) + NiDouă+(ac) → Ni (DMG)Două(s) + 2H+
El Ni (DMG)Două Se cântărește și cu un calcul stoichiometric se determină cantitatea de nichel conținută de proba.
Referințe
- Day, R. și Underwood, A. (1989). Chimie analitică cantitativă (ediția a cincea). PEARSON Prentice Hall.
- Harvey D. (23 aprilie 2019). Prezentare generală a metodelor gravimetrice. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Capitolul 12: Metode gravimetrice de analiză. [PDF]. Recuperat de pe: web.iyte.edu.tr
- Claude Yoder. (2019). Analiză gravimetrică. Recuperat de pe: wiredchemist.com
- Analiză gravimetrică. Recuperat de la: chem.tamu.edu
- Helmenstine, Anne Marie, dr. (19 februarie 2019). Analiza gravimetrică Definiție. Recuperat de pe: thoughtco.com
- Siti Maznah Kabeb. (s.f.). Chimie analitică: analiză gravimetrică. [PDF. Recuperat de la: ocw.ump.edu.my
- Singh N. (2012). O nouă metodă gravimetrică robustă, precisă și precisă pentru determinarea aurului: o alternativă la metoda de testare a focului. SpringerPlus, 1, 14. doi: 10.1186 / 2193-1801-1-14.


Nimeni nu a comentat acest articol încă.