
Structura hidroxidului de nichel (III), proprietăți, utilizări, riscuri

hidroxid de nichel (III) Este un compus anorganic în care nichelul metalic are un număr de oxidare de 3+. Formula sa chimică este Ni (OH)3. Potrivit surselor consultate, până în prezent nu s-a putut verifica existența hidroxidului de nichel (III) Ni (OH)3, dar a fost posibil să se obțină oxo-hidroxid de nichel (III), NiO (OH).
Oxohidroxidul de nichel (III) NiO (OH) este un solid cristalin negru care cristalizează în două forme: beta și gamma. Cea mai comună formă cristalină de NiO (OH) este beta.
NiO (OH) poate fi obținut prin oxidarea soluțiilor de azotat de nichel (II) (Ni (NO3)Două) cu clor (ClDouă) sau brom (BrDouă) în prezența hidroxidului de potasiu (KOH). Oxohidroxidul de nichel (III) este foarte solubil în acizi. Are aplicare în baterii de nichel, în supercondensatoare și ca catalizator regenerabil.
Hidroxid de nichel (III) NiO (OH) și hidroxid de nichel (II) Ni (OH)Două sunt uniți în funcționarea majorității aplicațiilor lor, deoarece ambele fac parte din aceeași ecuație de reducere a oxidului.
Fiind un compus din nichel, NiO (OH) prezintă aceleași riscuri ca și alte săruri de nichel, adică iritația pielii sau dermatita și cancerul.
Indice articol
- 1 Structură cristalină
- 2 Configurare electronică
- 3 Nomenclatură
- 4 Proprietăți
- 4.1 Starea fizică
- 4.2 Solubilitate
- 4.3 Alte proprietăți
- 5 utilizări
- 5.1 La bateriile de nichel
- 5.2 În electrocataliză ca catalizator regenerabil
- 5.3 La supercondensatoare
- 5.4 În oxidarea ionilor metalici
- 6 Riscuri
- 7 Referințe
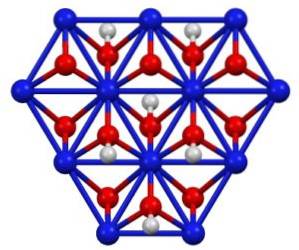
Structură cristalină
Oxohidroxidul de nichel (III) cristalizează în două forme: beta și gamma. Forma beta β-NiO (OH) are o structură foarte asemănătoare cu β-Ni (OH)Două, ceea ce pare logic întrucât primul provine din oxidarea celui din urmă.
Forma gamma γ-NiO (OH) este produsul de oxidare al hidroxidului de nichel (II) în forma sa alfa, α-Ni (OH)Două. La fel ca acesta din urmă, gama are o structură stratificată cu ioni de metal alcalin, anioni și apă intercalată între straturi..
Configurare electronică
În NiO (OH), nichelul se află în starea de oxidare 3+, ceea ce înseamnă că straturilor sale exterioare îi lipsesc 3 electroni, adică lipsesc doi electroni din stratul 4s și un electron din coajă 3d. Configurația electronică a Ni3+ în NiO (OH) este: [Ar] 3d7, unde [Ar] este configurația electronică a argonului cu gaz nobil.
Nomenclatură
- NiO (OH): oxohidroxid de nichel (III)
- Negru nichel
Proprietăți
Starea fizică
Solid cristalin negru.
Solubilitate
Oxohidroxidul de NiO (OH) este foarte solubil în acizi. Faza gamma se dizolvă în acid sulfuric cu evoluția oxigenului.
Alte proprietăți
În apa fierbinte devine nichel (II) și (III) oxohidroxid, Ni3SAUDouă(OH)4.
Se descompune la 140 ° C în oxid de nichel (II) (NiO), apă și oxigen.
Faza gamma (γ-NiO (OH)) poate fi obținută în diferite moduri, de exemplu, prin tratarea nichelului cu un amestec topit de peroxid de sodiu (NaDouăSAUDouă) și hidroxid de sodiu (NaOH) la 600 ° C și răcire în apă cu gheață.
Faza gamma se descompune la încălzire la 138 ° C.
Aplicații
În bateriile de nichel
Bateria de nichel-fier a lui Edison, în care KOH este utilizat ca electrolit, se bazează pe reacția oxohidroxidului de nichel (III) cu fierul:
Descarca:
Fe + 2NiO (OH) + HDouăO ⇔ Fe (OH)Două + 2Ni (OH)Două
Sarcină:
Este o reacție reversibilă de reducere a oxidării.
O serie de procese chimice și electrochimice au loc la anodul acestor baterii. Iată o schiță generală:
Descarca
β-Ni (OH)Două ⇔ β-NiO (OH) + H+ + și-
Sarcină
Îmbătrânire ↑ ↓ Suprasarcină
Descarca
α-Ni (OH)Două Γ-NiO (OH) + H+ + și-
Sarcină
În tehnologia bateriilor de nichel, oxohidroxidul de nichel (III) NiO (OH) este numit „masă activă de nichel”.

În electrocataliză ca catalizator regenerabil
NiO (OH) a fost utilizat cu succes în electrosinteza azopirazolilor, prin oxidarea electrocatalitică a aminopirazolilor. S-a dovedit, de asemenea, utilitatea sa în sinteza acizilor carboxilici pornind de la alcooli sau compuși carbonilici..

Un alt exemplu este conversia cantitativă a hidroximetilpiridinei într-un acid piridincarboxilic. În acest caz, electrodul din oțel sau nichel corespunzător anodului este acoperit cu un strat de NiO (OH). Mediul în care se efectuează electroliza este alcalin.
În aceste reacții, NiO (OH) acționează ca un mediator de reducere-oxidare sau mediator „redox”..
Electroliza se efectuează într-o celulă cu anod de nichel și catod de titan, într-un mediu alcalin. Ni (OH) se formează în timpul procesuluiDouă pe suprafața anodului de nichel, care se oxidează rapid la NiO (OH):
Ni (OH)Două + Oh- - și- ⇔ NiO (OH) + HDouăSAU
NiO (OH) reacționează cu substratul organic și se obține produsul organic dorit, regenerând Ni (OH)Două:
NiO (OH) + compus organic → Ni (OH)Două + produs
Pe măsură ce Ni (OH) se regenereazăDouă, se continuă reacția de cataliză.
Utilizarea NiO (OH) ca electrocatalizator permite obținerea de compuși organici cu costuri reduse și într-un mod ecologic.
În supercondensatoare
NiO (OH) împreună cu Ni (OH)Două face materiale excelente pentru electrozi supercondensatori. supercondensatoare).
Ni (OH)Două + Oh- ⇔ NiO (OH) + HDouăO + e-
Au o capacitate ridicată, un cost redus și, conform unor referințe, un impact scăzut asupra mediului.

Cu toate acestea, au o conductivitate scăzută. Acest lucru este rezolvat folosind nanoparticule ale compușilor menționați, deoarece aceasta mărește suprafața și scade distanța necesară difuziei, ceea ce asigură o viteză mare de transfer al electronilor și / sau ionilor..
În oxidarea ionilor metalici
Una dintre aplicațiile comerciale ale oxohidroxidului de nichel (III) se bazează pe capacitatea sa de a oxida ionii de cobalt (II) în soluție la ionii de cobalt (III)..
Riscuri
Nichelul în soluție este mai stabil ca ionul NiDouă+, de aceea nu este obișnuit să intrați în contact cu soluțiile de Ni3+. Cu toate acestea, măsurile de precauție sunt aceleași, deoarece nichelul, indiferent dacă este metalic, în soluție sau sub formă de săruri solide, poate provoca sensibilizarea pielii..
Este recomandabil să folosiți echipament de protecție și îmbrăcăminte, cum ar fi un scut facial, mănuși și încălțăminte de protecție. Toate acestea trebuie utilizate ori de câte ori există posibilitatea de a intra în contact cu soluții de nichel..
Dacă apare dermatită, trebuie tratată cu un medic pentru a exclude că este cauzată de nichel..
În ceea ce privește posibilitatea inhalării, este o bună practică să mențineți concentrațiile aeriene de praf de săruri de nichel foarte mici, prin ventilație locală și să utilizați protecție respiratorie atunci când este necesar..
Toți compușii de nichel sunt clasificați de Agenția Internațională pentru Cercetarea Cancerului sau IARC. Agenția Internațională pentru Cercetarea Cancerului), în categoria agenților cancerigeni pentru oameni.
Aceasta se bazează pe date epidemiologice și experimentale.
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Lyalin, B.V. și colab. Electrosinteza azopirazolilor prin oxidarea N-alchilaminopirazolilor pe un anod NiO (OH) în alcalin apos - O metodă verde pentru homocuplarea N-N. Litere de tetraedru. 59 (2018) 2741-2744. Recuperat de la sciencedirect.com.
- Liuyang, Zhang și colab. (2018). Materiale pe bază de nichel pentru supercondensatoare. Materiale astăzi. Recuperat de la sciencedirect.com
- Ettel, V.A. și Mosolu, M. A. (1977). Prepararea nichelului negru. S.U.A. Brevetul nr. 4.006.216. 1 februarie 1977.
- Scharbert, B. (1993). Procedeu de oxidare a derivaților hidroximetilpiridinici la derivați ai acidului piridincarboxilic la anodi hidroxid de nichel. S.U.A. Brevetul nr. 5.259.933. 9 noiembrie 1993.
- Kirk-Othmer (1994). Enciclopedia Tehnologiei Chimice. Volumul 17. Ediția a patra. John Wiley & Sons.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. Volumul A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Hidroxizi de nichel. În Manualul materialelor pentru baterii. VCH Publisher. Recuperat de la osti.gov.



Nimeni nu a comentat acest articol încă.