
Hexan (C6H14) proprietăți fizice și chimice, structură, utilizări, toxicitate
hexan este o hidrocarbură caracterizată prin faptul că este un compus organic a cărui formulă chimică condensată este C6H14. Este un lichid incolor, transparent, care nu poate fi amestecat cu apă. Are cinci izomeri, cel liniar fiind unul dintre cele mai importante hidrocarburi parafinice din industrie și cercetare.
Hexanul se obține prin distilarea fracționată a țițeiului. De asemenea, este prezent în mod natural în citrice și în fracțiuni volatile de diverse plante sau fructe, cum ar fi măr, guava, alune prăjite, cartof dulce și salvie..
Este un lichid volatil foarte inflamabil găsit în benzină, lipici cu uscare rapidă și ciment de cauciuc. Hexanul este utilizat ca solvent în procesul de extracție a uleiurilor vegetale, precum și a lipidelor și grăsimilor prezente în apa și solurile contaminate.
Persoanele care sunt expuse profesional la hexan pot prezenta leziuni ale sistemului nervos periferic, manifestate prin furnicături și crampe la nivelul picioarelor și brațelor; pe lângă slăbiciunea musculară generalizată și, în cazuri severe, atrofia mușchilor scheletici.
Indice articol
- 1 Proprietățile fizice și chimice ale hexanilor
- 1.1 Aspect fizic
- 1.2 Masa molară
- 1.3 Miros
- 1.4 Pragul mirosului
- 1.5 Densitate
- 1.6 Punct de topire
- 1.7 Punctul de fierbere
- 1.8 Punct de aprindere
- 1.9 Solubilitatea în apă
- 1.10 Solubilitate în solvenți
- 1.11 Densitatea relativă a vaporilor cu aerul
- 1.12 Coeficientul de partiție octanol / apă
- 1.13 Presiunea vaporilor
- 1.14 Lungimea de undă a densității optice maxime
- 1.15 Indicele de refracție
- 1.16 Vâscozitatea
- 1.17 Capacitatea calorică
- 1.18 Căldura de ardere
- 1.19 Căldura de vaporizare
- 1.20 Tensiunea superficială
- 1.21 Potențial de ionizare
- 1.22 Stabilitate
- 1.23 Reactivitate
- 2 Structura hexanului
- 2.1 Interacțiuni intermoleculare
- 2.2 Izomeri
- 3 utilizări
- 4 Toxicitate
- 4.1 Inhalare și contact
- 4.2 Doza sigură
- 5 Referințe
Proprietățile fizice și chimice ale hexanilor
Aspectul fizic
Lichid incolor, transparent și foarte volatil.
Masă molară
86,178 g / mol
Miros
Similar cu benzina
Pragul mirosului
1,5 ppm
Densitate
0,6606 g / ml
Punct de topire
-96 la -94 ºC
Punct de fierbere
68,5 până la 69,1 ºC
punctul de aprindere
-22 ºC (cupă închisă).
Solubilitatea apei
9,5 mg / L (practic nemiscibil cu apa)
Solubilitatea în solvenți
Foarte solubil în etanol, solubil în eter etilic și cloroform. Miscibil cu alcool, cloroform și eter.
Densitatea relativă a vaporilor cu aerul
2,97 (aer = 1)
Coeficientul de partiție octanol / apă
Jurnal P = 3.764
Presiunea de vapori
17,60 kPa la 20 ° C
Lungimea de undă a densității optice maxime
200 nm
Indicele de refracție
1.375
Viscozitate
0,3 mPa s
Capacitatea calorică
265.2 JK-1Cârtiță-1
Căldura de ardere
4.163,2 kJ mol-1
Căldura de vaporizare
31,56 kJ mol-1
Tensiune de suprafata
17,89 mN / m la 25 ° C
Potențial de ionizare
10,18 eV
Stabilitate
Grajd. Incompatibil cu agenți de oxidare, clor, fluor, perclorat de magneziu. Formează un amestec exploziv cu aerul.
Reactivitate
Hexanul poate reacționa viguros cu materiale oxidante, care pot include clor lichid, oxigen concentrat, hipoclorit de sodiu și hipoclorit de calciu. De asemenea, este incompatibil cu tetroxidul de dinitrogen. Hexanul poate ataca unele forme de materiale plastice, cauciuc și acoperiri.
Structura hexanului
Interacțiuni intermoleculare
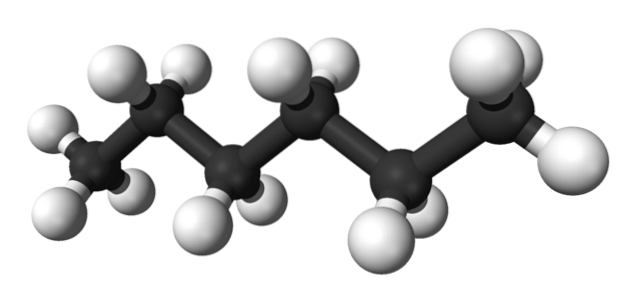
Prima imagine prezintă molecula de n-hexan reprezentat printr-un model cu bilă și băț. Sferele negre corespund atomilor de carbon, alcătuind scheletul de carbon în zigzag, în timp ce sferele albe sunt atomii de hidrogen. n-Hexanul este deci o hidrocarbură, liniară și extrem de dinamică.
Deoarece toate legăturile sale C-H sunt de polaritate scăzută, moleculei îi lipsește un moment dipolar. Procedând astfel, interacțiunile lor intermoleculare nu sunt de tip dipol-dipol, ci depind exclusiv de masa moleculară și de forțele dispersive ale Londrei..
Fiecare moleculă de n-Hexanul „se potrivește” unul peste altul la temperaturi foarte scăzute, așa cum s-ar presupune în structura sa cristalină. Pe de altă parte, în lichid scheletele lor se flexează și își rotesc legăturile C-H, determinând lichidul menționat volatil și fierbe la 68,7 ºC..
Izomeri
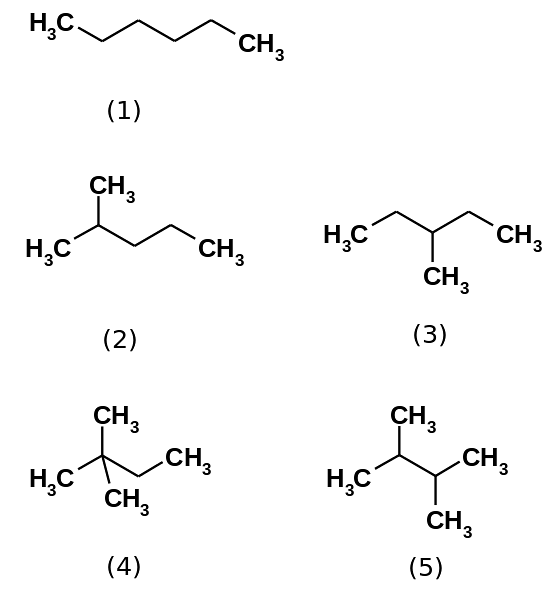
Hexanul hidrocarbonat constă de fapt din cinci izomeri, fiind n-hexan cel mai puțin ramificat, (1). Ceilalți patru izomeri sunt, în ordine crescătoare:
2-metilpropan (2)
3-metilpropan (3)
2,2-dimetilbutan (4)
2,3-dimetilbutan (5)
De asemenea, rețineți că structurile devin mai ramificate de la (1) la (5). Fiind mai ramificate, forțele de dispersie scad, întrucât nu mai există porțiuni liniare care să se încurce eficient. Acest lucru duce la o scădere și variație a punctelor de fierbere ale izomerilor; deși se observă unele discrepanțe acceptabile.
Atât 2-metilpropanul (bp = 60,3 ° C), cât și 3-metilpropanul (bp = 63,3 ° C) sunt ramificate în mod egal, dar punctele lor de fierbere sunt diferite. Apoi este urmat de 2,3-dimetilbutan (peb = 58 ºC), pentru a localiza în cele din urmă 2,2-dimetilbutan ca cel mai volatil lichid (peb = 49,7 ºC).
Aplicații
Hexanul este amestecat cu substanțe chimice similare pentru a produce solvenți. Printre denumirile date acestor solvenți se numără hexanul comercial, hexanii amestecați etc. Acestea sunt folosite ca agenți de curățare în industria textilă, mobilă și tipografie..
Hexanul este un ingredient în cleiurile utilizate în hidroizolația acoperișului, încălțăminte și piele. Este, de asemenea, utilizat pentru legarea cărților, pentru turnarea pastilelor și tabletelor, conservarea, fabricarea anvelopelor și a mingilor de baseball..
Hexanul este utilizat la determinarea indicelui de refracție a mineralelor și a lichidului de umplere pentru termometre în loc de mercur; de obicei cu o nuanță roșie sau albastră. De asemenea, este utilizat la extragerea grăsimilor și a uleiului din apă pentru analiza contaminanților săi..
Hexanul este utilizat ca solvent în extracția uleiului din semințe de legume, cum ar fi soia, canola sau mur. În plus, este folosit pentru a degresa părți de diferite origini. Este utilizat în denaturarea alcoolului, în metoda de analiză HPLC și în spectrofotometrie.
Toxicitate
Inhalare și contact
Toxicitatea acută a hexanului este relativ scăzută, deși este un anestezic ușor. Expunerea acută la concentrații mari de hexan poate produce, prin inhalare, depresie ușoară a sistemului nervos central (SNC), manifestată prin amețeli, vertij, greață ușoară și cefalee..
De asemenea, poate provoca dermatită și iritații la nivelul ochilor și gâtului. Inhalarea cronică a hexanului, legată de activitatea de lucru, poate provoca leziuni ale sistemului nervos periferic (polineuropatia senzoriomotorie).
Simptomele inițiale sunt furnicături și crampe la nivelul picioarelor și brațelor, urmate de slăbiciune musculară. În cazurile severe, poate apărea atrofia mușchilor scheletici, împreună cu pierderea coordonării și a problemelor de vedere.
Toxicitatea hexanului este legată de generarea metabolitului hexan-2,5-dionă. Reacționează cu aminoacidul lizină al unui lanț lateral proteic, provocând pierderea funcției proteice..
Doza sigură
Agenția pentru Protecția Mediului (EPA) a calculat o concentrație de referință (RfC) pentru hexan de 0,2 mg / m3, și o doză de referință (RfD) de 0,06 mg / kg de greutate corporală / zi.
În anii 1960 și 1970, un grup de muncitori din industria cizmariei din Japonia avea prezența tulburărilor nervoase. Cauza a fost că au respirat într-o atmosferă hexanică de 500 - 2.500 ppm, timp de 8-14 ore pe zi.
Muncitorii au prezentat simptomele cunoscute ale inhalării cronice a hexanului, descoperind medicii că nervii care controlează mușchii brațelor și picioarelor au fost deteriorați..
Referințe
- Danielle Reid. (2019). Hexan: Structură, Formula și proprietăți. Studiu. Recuperat de la: study.com
- Centrul Național pentru Informații despre Biotehnologie. (2019). Hexane. Baza de date PubChem. CID = 8058. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Hexane. Recuperat de pe: en.wikipedia.org
- Lumea Moleculelor. (s.f.). Molecula de hexan. Recuperat de pe: worldofmolecules.com
- Carte chimică. (2017). Hexane. Recuperat de pe: chemicalbook.com
- Comunitatea Australiei. (s.f.). n-hexan: surse de emisii. Recuperat de pe: npi.gov.au
- EPA. (2000). Hexane. [PDF]. Recuperat de la: epa.gov
- Agenția pentru Registrul Substanțelor Toxice și al Bolilor. (1999). Declarație de sănătate publică pentru n-Hexane. Recuperat de la: atsdr.cdc.gov



Nimeni nu a comentat acest articol încă.