
Ce este hidroliza și exemple de reacții

hidroliză Este o reacție chimică care poate apărea atât în molecule sau ioni anorganici, cât și organici și care implică participarea apei pentru a le rupe legăturile. Numele său provine din greacă, „hidro” a apei și „liza” rupturii.
Molecula de apă, HDouăSau, stabilește un echilibru cu ionii de săruri ale acizilor și bazelor slabe, acest concept apărând pentru prima dată în studiile generale de chimie și în chimia analitică. Prin urmare, este una dintre cele mai simple reacții chimice.
În câteva exemple de hidroliză, apa singură nu este capabilă să rupă o anumită legătură covalentă. Când se întâmplă acest lucru, procesul este accelerat sau catalizat prin acidificarea sau alcalinizarea mediului; adică în prezența ionilor H3SAU+ oh OH-, respectiv. La fel, există enzime care catalizează hidroliza.
Hidroliza ocupă un loc special în ceea ce privește biomoleculele, deoarece legăturile care își mențin monomerii împreună sunt susceptibile de hidrolizare în anumite condiții. De exemplu, zaharurile sunt hidrolizate pentru a descompune polizaharidele în monozaharidele lor constitutive datorită acțiunii enzimelor glucozidazei.
Indice articol
- 1 Ce este hidroliza?
- 2 Exemple de reacții de hidroliză
- 2.1 - ATP
- 2.2 - Apă
- 2.3 - Proteine
- 2.4 - Amide și esteri
- 2.5 - Acid-bazic
- 3 Referințe
Ce este hidroliza?
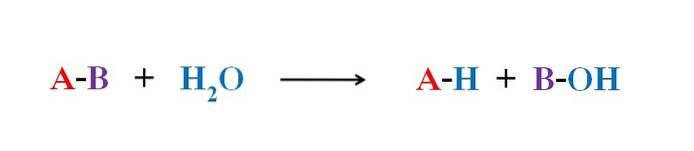
Imaginea de mai sus explică în ce constă hidroliza. Rețineți că nu numai molecula sau substratul (dacă enzimele mediază) își rup legătura, ci și apa în sine, care se „fracturează” în H+ și OH-, unde H+ se termină cu A și OH- cu B. A-B reacționează astfel cu o moleculă de apă producând două produse, A-H și B-OH.
Prin urmare, hidroliza este reacția opusă condensului. În condensare, două produse, ca să spunem A-H și B-OH, se unesc prin eliberarea unei molecule mici: apa. În hidroliză se consumă o moleculă, în timp ce în condensare este eliberată sau produsă.
Revenind la exemplul de zaharuri, să presupunem că A-B corespunde unui dimer de zaharoză, unde A reprezintă glucoză, iar B reprezintă fructoză. Legătura A-B, glicozidică, poate fi hidrolizată pentru a provoca separat cele două monozaharide și în soluție, la fel se întâmplă cu oligo și polizaharidele dacă enzimele mediază în astfel de reacții.
Rețineți că în această reacție, A-B, săgeata are o singură direcție; adică este o hidroliză ireversibilă. Cu toate acestea, multe hidrolize sunt de fapt reacții reversibile care ajung la un echilibru.
Exemple de reacții de hidroliză
- ATP
ATP este stabil între valorile pH-ului de 6,8 și 7,4. Cu toate acestea, la valori extreme ale pH-ului, se hidrolizează spontan. La ființele vii, hidroliza este catalizată de enzime cunoscute sub numele de ATPaze:
ATP + HDouăO => ADP + Pi
Această reacție este puternic exergonică, deoarece entropia ADP este mai mare decât cea a ATP. Variația energiei libere Gibbs (ΔGº) este - 30,5 kJ / mol. Energia produsă de hidroliza ATP este utilizată în numeroase reacții endergonice.
Reacții cuplate
În unele cazuri, hidroliza ATP este utilizată pentru conversia unui compus (A) într-un compus (B).
A + ATP + HDouăSAU <=> B + ADP + Pi + H+
- Apă
Două molecule de apă pot reacționa între ele în hidroliza aparentă:
HDouăO + HDouăSAU <=> H3SAU+ + Oh-
Este ca și cum una dintre acele molecule de apă s-a fracturat în H+ și OH-, urmând să legați H+ la atomul de oxigen al celeilalte molecule de apă, care dă naștere ionului de hidroniu, H3SAU+. Această reacție, mai mult decât hidroliza, se referă la autoionizarea sau autoprotoliza apei.
- Proteină
Proteinele sunt macromolecule stabile și pentru a realiza hidroliza completă a acestora, în aminoacizii care le constituie sunt necesare condiții extreme; precum o concentrație de acid clorhidric (6 M) și temperaturi ridicate.
Cu toate acestea, ființele vii sunt înzestrate cu un arsenal enzimatic care permite hidroliza proteinelor în aminoacizi din duoden. Enzimele implicate în digestia proteinelor sunt secretate aproape în totalitate de pancreas.
Există enzime exopeptidază care degradează proteinele, începând de la capetele lor: aminopeptidază la capătul amino și carboxipeptidază la capătul carboxil. Enzimele endopeptidazei își exercită acțiunea în interiorul lanțului proteic, de exemplu: tripsină, pepsină, chimotripsină etc..
- Amide și esteri
Amidele, atunci când sunt încălzite într-un mediu alcalin, dau naștere unui acid carboxilic și a unei amine:
RCONHDouă + HDouăO => RCOO- + NHDouă
Esterii într-un mediu apos sunt hidrolizați în acid carboxilic și alcool. Procesul este catalizat fie de o bază, fie de un acid:
RCO-OR '+ HDouăO => RCOOH + R'OH
Aceasta este faimoasa reacție de saponificare.
- Bază acidă
În apă, mai multe specii sunt hidrolizate pentru a acidifica sau alcaliniza mediul apos.
Adăugarea unei sări de bază
Acetat de sodiu, o sare bazică, se disociază în apă pentru a da ioni Na+ (sodiu) și CH3GÂNGURI- (acetat). Basicitatea sa se datorează faptului că acetatul este hidrolizat pentru a genera ioni OH-, în timp ce sodiul rămâne neschimbat:
CH3GÂNGURI- + HDouăSAU <=> CH3COOH + OH-
OH- este responsabil ca pH-ul să crească și să devină de bază.
Adăugarea unei sări acide
Clorură de amoniu (NH4Cl) este format din ionul clorură (Cl-) din acid clorhidric (HCI), un acid puternic și cationul de amoniu (NH4+) din hidroxid de amoniu (NH4OH), o bază slabă. Cl- Nu se disociază în apă, dar cationul de amoniu se transformă în apă după cum urmează:
NH4+ + HDouăSAU <=> NH3 + H3SAU+
Hidroliza cationului de amoniu produce protoni care cresc aciditatea unui mediu apos, de aceea se concluzionează că NH4Cl este o sare acidă.
Adăugarea unei sări neutre
Clorura de sodiu (NaCl) este un produs sărat al reacției unei baze puternice (NaOH) cu un acid puternic (HCl). Prin dizolvarea clorurii de sodiu în apă, cationul de sodiu (Na+) și anionul (Cl-). Ambii ioni nu se disociază în apă, deci nu adaugă H+ oh OH-, păstrându-și pH-ul constant.
Prin urmare, se spune că clorura de sodiu este o sare neutră..
Referințe
- Mathews, C. K., van Holde, K. E. și Ahern, K. G. (2002). Biochimie. (A treia editie). Editați | ×. Pearson-Addison Wesley.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Helmenstine, Anne Marie, dr. (13 ianuarie 2019). Hidroliza: definiție și exemple. Recuperat de pe: thoughtco.com
- Theresa Phillips. (28 aprilie 2019). O explicație a procesului de hidroliză. Recuperat de pe: thebalance.com
- Editorii Enciclopediei Britanice. (2016, 16 noiembrie). Hidroliză. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Wikipedia. (2019). Hidroliză. Recuperat de pe: en.wikipedia.org



Nimeni nu a comentat acest articol încă.