
Structura hidroxidului de aluminiu, proprietăți, utilizări, riscuri
hidroxid de aluminiu este un compus anorganic a cărui formulă chimică este Al (OH)3. Spre deosebire de alți hidroxizi metalici, este unul amfoteric, capabil să reacționeze sau să se comporte ca un acid sau o bază, în funcție de mediu. Este un solid alb destul de insolubil în apă, deci își găsește utilizarea ca componentă a antiacidelor.
Ca Mg (OH)Două sau brucită, cu care împărtășește anumite caracteristici chimice și fizice, în formă pură arată ca un solid plictisitor, amorf; dar când cristalizează cu unele impurități, capătă forme cristaline ca și când ar fi perle. Printre aceste minerale, surse naturale de Al (OH)3, gibbsite este găsit.

Pe lângă gibbsite există și mineralele bayerită, nordstrandită și doleiită, care alcătuiesc cele patru polimorfe ale hidroxidului de aluminiu. Structural, acestea sunt foarte asemănătoare între ele, diferind cu greu de modul în care straturile sau foile de ioni sunt poziționate sau cuplate, precum și tipul de impurități conținute.
Prin controlul parametrilor de pH și de sinteză, oricare dintre aceste polimorfe poate fi preparat. De asemenea, unele specii chimice de interes pot fi intercalate între straturile sale, astfel încât să se creeze materiale sau compuși de intercalație. Aceasta reprezintă utilizarea unei abordări mai tehnologice pentru Al (OH)3. Celelalte utilizări ale sale sunt ca antiacide.
Pe de altă parte, este utilizat ca materie primă pentru obținerea aluminei, iar nanoparticulele sale au fost utilizate ca suport catalitic..
Indice articol
- 1 Structură
- 1.1 Formula și octaedrul
- 1.2 Polimorfi
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Densitatea
- 2.4 Punct de topire
- 2.5 Solubilitate în apă
- 2.6 Produs de solubilitate
- 2.7 Amfotericism
- 3 Nomenclatură
- 4 utilizări
- 4.1 Materie primă
- 4.2 Suporturi catalitice
- 4.3 Compuși de intercalație
- 4.4 ignifug
- 4.5 Medicamentos
- 4.6 Adsorbant
- 5 Riscuri
- 6 Referințe
Structura
Formula și octaedrul
Formula chimică Al (OH)3 indică imediat că relația Al3+: OH- este 1: 3; adică există trei anioni OH- pentru fiecare Al cation3+, ceea ce este la fel ca a spune că o treime din ionii săi corespund aluminiului. Astfel, Al3+ și OH- interacționează electrostatic până când atracția-repulsiile lor definesc un cristal hexagonal.
Cu toate acestea, Al3+ nu neapărat înconjurat de trei OH- dar șase; prin urmare, vorbim despre un octaedru de coordonare, Al (OH)6, în care există șase interacțiuni Al-O. Fiecare octaedru reprezintă o unitate cu care este construit cristalul, iar un număr dintre ei adoptă structuri triclinice sau monoclinice.
Imaginea de jos reprezintă parțial octaedrele Al (OH)6, întrucât doar patru interacțiuni sunt observate pentru Al3+ (sfere maro deschis).
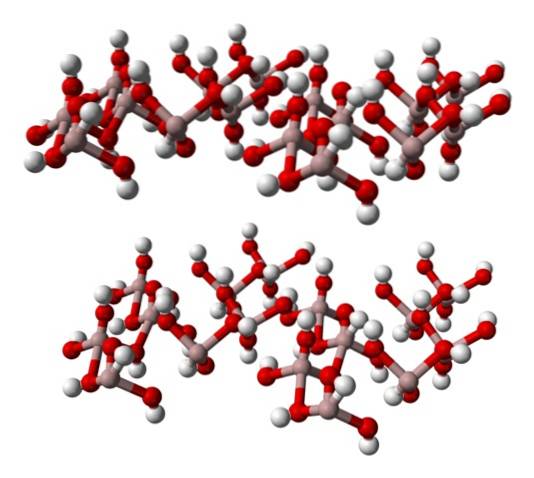
Dacă această structură este atent observată, care corespunde cu cea a gibbsite-ului mineral, se poate observa că sferele albe alcătuiesc „fețele” sau suprafețele straturilor ionice; aceștia sunt atomii de hidrogen ai ionilor OH-.
Rețineți, de asemenea, că există un strat A și un alt B (spațial nu sunt identice), unite între ele prin legături de hidrogen..
Polimorfe
Straturile A și B nu sunt întotdeauna cuplate în același mod, la fel cum mediile lor fizice sau ionii gazdă (săruri) se pot schimba. În consecință, cristalele de Al (OH)3 variază în patru forme mineralogice sau, în acest caz, polimorfe.
Se spune apoi că hidroxidul de aluminiu are până la patru polimorfi: gibbsite sau hydrargillite (monoclinice), bayerite (monoclinice), doyleite (triclinice) și nordstrandite (triclinice). Dintre acești polimorfi, gibbsite este cel mai stabil și abundent; celelalte sunt clasificate ca minerale rare.
Dacă cristalele ar fi observate la microscop, s-ar vedea că geometria lor este hexagonală (deși oarecum neregulată). PH-ul joacă un rol important în creșterea acestor cristale și asupra structurii rezultate; adică, având un pH, se poate forma un polimorf sau altul.
De exemplu, dacă mediul în care precipită Al (OH)3 are un pH mai mic de 5,8 gibbsite este format; în timp ce dacă pH-ul este mai mare decât această valoare, se formează bayerită.
În medii mai de bază, se formează cristale de nordstrandit și doyleit. Astfel, fiind cel mai abundent gibbsite, este un fapt care reflectă aciditatea mediilor sale degradate..
Proprietăți
Aspectul fizic
Solid alb, care poate fi prezentat în diferite formate: granular sau pulbere și cu aspect amorf.
Masă molară
78,00 g / mol
Densitate
2,42 g / ml
Punct de topire
300 ° C. Nu are punct de fierbere deoarece hidroxidul pierde apă pentru a se transforma în alumină sau oxid de aluminiu, AlDouăSAU3.
Solubilitatea apei
1 10-4 g / 100 ml. Cu toate acestea, solubilitatea sa crește odată cu adăugarea de acizi (H3SAU+) sau alcalii (OH-).
Produs de solubilitate
Ksp = 3 10−34
Această valoare foarte mică înseamnă că doar o mică porțiune se dizolvă în apă:
Al (OH)3(s) <=> Pentru3+(aq) + 3OH-(ac)
Și, de fapt, această solubilitate neglijabilă îl face un bun neutralizator al acidității, deoarece nu bazifică prea mult mediul gastric, deoarece nu eliberează aproape ioni OH.-.
Amfotericism
El Al (OH)3 se caracterizează prin caracterul său amfoteric; adică poate reacționa sau se poate comporta ca și cum ar fi un acid sau o bază.
De exemplu, reacționează cu ionii H3SAU+ (dacă mediul este apos) pentru a forma complexul apos [Al (OHDouă)6]3+; care, la rândul său, este hidrolizat pentru a acidifica mediul, deci Al3+ un ion acid:
Al (OH)3(s) + 3H3SAU+(ac) => [Al (OHDouă)6]3+(ac)
[Al (OHDouă)6]3+(ac) + HDouăO (l) <=> [Al (OHDouă)5(OH)]Două+(ac) + H3SAU+(ac)
Când se întâmplă acest lucru, se spune că Al (OH)3 se comportă ca o bază, deoarece reacționează cu H3SAU+. Pe de altă parte, poate reacționa cu OH-, comportându-se ca un acid:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
În această reacție precipitatul alb de Al (OH)3 se dizolvă în exces de ioni OH-; fapt care nu se întâmplă la fel cu alți hidroxizi, cum ar fi magneziu, Mg (OH)Două.
El Al (OH)4-, ion aluminat, poate fi exprimat mai adecvat ca: [Al (OHDouă)Două(OH)4]-, evidențiind numărul de coordonare de 6 pentru Al cation3+ (octaedrul).
Acest ion poate continua să reacționeze cu mai mult OH- până la finalizarea octaedrului de coordonare: [Al (OH)6]3-, numit ion hexahidroxoaluminat.
Nomenclatură
Denumirea de „hidroxid de aluminiu”, cu care s-a făcut mai multă referință la acest compus, corespunde cu cea reglementată de nomenclatura stocului. (III) este omis la sfârșitul acestuia, deoarece starea de oxidare a aluminiului este de +3 în toți compușii săi.
Celelalte două nume posibile pentru a se referi la Al (OH)3 Acestea sunt: trihidroxid de aluminiu, conform nomenclaturii sistematice și a utilizării prefixelor numeratoare grecești; și hidroxid de aluminiu, care se termină cu sufixul -ico pentru a avea o singură stare de oxidare.
Deși în domeniul chimic nomenclatura Al (OH)3 nu reprezintă nicio provocare sau confuzie, în afara ei tinde să fie amestecată cu ambiguități.
De exemplu, gibbsite-ul mineral este unul dintre polimorfii naturali ai Al (OH)3, pe care îl numesc și γ-Al (OH)3 sau α-Al (OH)3. Cu toate acestea, α-Al (OH)3 poate corespunde, de asemenea, bayeritei minerale sau β-Al (OH)3, conform nomenclaturii cristalografice. Între timp, polimorfii nordstrandit și doyleit sunt de obicei desemnați pur și simplu ca Al (OH)3.
Următoarea listă rezumă în mod clar ceea ce tocmai a fost explicat:
-Gibbsite: (γ sau α) -Al (OH)3
-Bayerit: (α sau β) -Al (OH)3
-Nordstrandit: Al (OH)3
-Doyleite: Al (OH)3
Aplicații
Materii prime
Utilizarea imediată pentru hidroxid de aluminiu este ca materie primă pentru producerea de alumină sau alți compuși, anorganici sau organici, din aluminiu; de exemplu: AlCl3, De nu3)3, AlF3 sau NaAl (OH)4.
Suporturi catalitice
Nanoparticule de Al (OH)3 pot acționa ca suport catalitic; adică catalizatorul se alătură acestora pentru a rămâne fixați pe suprafața lor, unde reacțiile chimice sunt accelerate.
Compuși de intercalație
În secțiunea privind structurile sa explicat că Al (OH)3 Se compune din straturi sau foi A și B, cuplate pentru a defini un cristal. În interiorul său, există mici spații octaedrice sau găuri care pot fi ocupate de alți ioni, molecule metalice sau organice sau neutre..
Când se sintetizează cristale de Al (OH)3 Cu aceste modificări structurale, se spune că se pregătește un compus de intercalație; adică inserează sau inserează specii chimice între foile A și B. În acest fel, apar noi materiale realizate din acest hidroxid.
Ignifug
El Al (OH)3 este un bun ignifug care își găsește aplicarea ca material de umplutură pentru multe matrice polimerice. Acest lucru se datorează faptului că absoarbe căldura pentru a elibera vapori de apă, la fel ca Mg (OH).Două sau brucita.
Medicinal
El Al (OH)3 Este, de asemenea, un neutralizator al acidității, care reacționează cu HCl în secrețiile gastrice; din nou, similar cu Mg (OH)Două lapte de magnezie.
Ambii hidroxizi pot fi de fapt amestecați în diferite antiacide, utilizate pentru ameliorarea simptomelor persoanelor care suferă de gastrită sau ulcere gastrice..
Adsorbant
Când este încălzit sub punctul său de topire, hidroxidul de aluminiu se transformă în alumină activă (precum și cărbune activ). Acest solid este utilizat ca adsorbant pentru molecule nedorite, fie că sunt coloranți, impurități sau gaze poluante..
Riscuri
Riscurile pe care le poate prezenta hidroxidul de aluminiu nu se datorează acestuia ca solid, ci ca medicament. Nu are nevoie de niciun protocol sau reglementări pentru a-l depozita, deoarece nu reacționează energic cu agenții oxidanți și nu este inflamabil..
Atunci când este ingerat în antiacide disponibile în farmacii, pot apărea reacții adverse nedorite, cum ar fi constipația și inhibarea fosfatului din intestine. De asemenea, și, deși nu există studii care să o demonstreze, a fost asociată cu tulburări neurologice, cum ar fi boala Alzheimer.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Hidroxid de aluminiu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Hidroxid de aluminiu. Baza de date PubChem. CID = 10176082. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Hidroxid de aluminiu: Formula și efecte secundare. Studiu. Recuperat de la: study.com
- Robert Schoen și Charles E. Roberson. (1970). Structuri ale hidroxidului de aluminiu și implicații geochimice. Mineralogul american, vol. 55.
- Vitaly P. Isupov & col. (2000). Sinteza, structura, proprietățile și aplicarea compușilor de intercalare a hidroxidului de aluminiu. Chimie pentru dezvoltare durabilă 8,121-127.
- Droguri. (24 martie 2019). Efecte secundare ale hidroxidului de aluminiu. Recuperat de pe: drugs.com

Nimeni nu a comentat acest articol încă.