
Structura, proprietățile, producția, utilizările hidroxidului de calciu (Ca (OH) 2)

hidroxid de calciu este un compus anorganic a cărui formulă chimică este Ca (OH)Două. Este o pulbere albă care a fost folosită de mii de ani, timp în care a câștigat mai multe nume tradiționale sau porecle; printre acestea, putem menționa var stins, mort, chimic, hidratat sau fin.
În natură este disponibil într-un mineral rar numit portlandit, de aceeași culoare. Din cauza acestui Ca (OH)Două Nu se obține direct din acest mineral, ci dintr-un tratament termic, urmat de hidratare, a calcarului. Din aceasta se obține var, CaO, care mai târziu este stins sau hidratat pentru a produce Ca (OH)Două.

Ca (OH)Două este o bază relativ slabă în apă, deoarece se poate dizolva cu greu în apă fierbinte; dar solubilitatea sa crește în apă rece, deoarece hidratarea sa este exotermă. Cu toate acestea, elementul său de bază continuă să fie un motiv pentru a fi atent cu el în timpul manipulării, deoarece poate provoca arsuri în orice parte a corpului..
A fost utilizat ca regulator de pH pentru diferite materiale sau alimente, precum și ca o sursă bună de calciu în ceea ce privește masa sa. Are aplicații în industria hârtiei, în dezinfecția apelor uzate, în produsele de depilare, în produsele alimentare din făină de porumb.
Cu toate acestea, utilizarea sa cea mai importantă a fost ca material de construcție, deoarece varul se hidratează atunci când este amestecat cu celelalte ingrediente din tencuială sau mortar. În aceste amestecuri întărite, Ca (OH)Două absoarbe dioxidul de carbon din aer pentru a consolida cristalele de nisip împreună cu cele formate din carbonat de calciu.
În prezent, se desfășoară încă cercetări cu scopul de a dezvolta materiale de construcție mai bune care au Ca (OH)Două direct în compoziția sa ca nanoparticule.
Indice articol
- 1 Structură
- 1.1 Cristalul și ionii săi
- 1.2 Morfologie
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Punctul de topire
- 2.4 Densitatea
- 2,5 pH
- 2.6 Solubilitatea în apă
- 2,7 Kps
- 2.8 Indicele de refracție
- 2.9 Stabilitate
- 3 Obținerea
- 4 utilizări
- 4.1 Tratamentul alimentelor
- 4.2 Dezinfectant de canalizare
- 4.3 Industria hârtiei
- 4.4 Absorbant de gaz
- 4.5 Îngrijirea personală
- 4.6 Lucrări de construcții
- 5 Riscuri și efecte secundare
- 6 Referințe
Structura
Cristalul și ionii săi
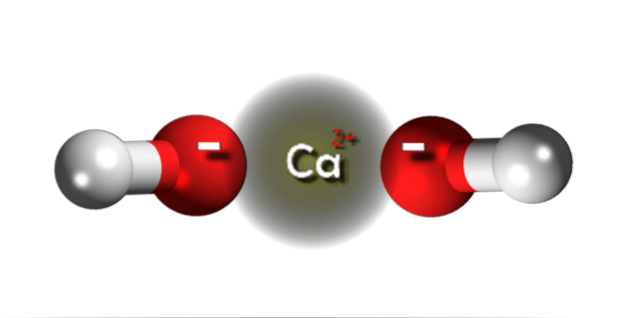
În imaginea superioară avem ionii care alcătuiesc hidroxidul de calciu. Aceeași formulă Ca (OH)Două subliniază că pentru fiecare cation CaDouă+ există doi anioni OH- care interacționează cu el prin atracție electrostatică. Rezultatul este că ambii ioni ajung să stabilească un cristal cu o structură hexagonală.
În astfel de cristale hexagonale de Ca (OH)Două ionii sunt foarte apropiați unul de celălalt, ceea ce dă aspectul de a fi o structură polimerică; deși nu există formal o legătură covalentă Ca-O dată fiind diferența notabilă de electronegativitate între cele două elemente.
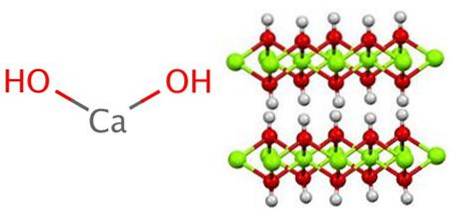
Structura generează octaedre CaO6, adică Ca.Două+ interacționează cu șase OH- (ACDouă+-Oh-).
O serie din aceste octaedre alcătuiesc un strat al cristalului, care poate interacționa cu altul prin legături de hidrogen care le mențin coezive intermolecular; cu toate acestea, această interacțiune dispare la o temperatură de 580 ºC, când Ca (OH) este deshidratatDouă la CaO.
În ceea ce privește presiunile ridicate, nu există prea multe informații în acest sens, deși studiile au arătat că la o presiune de 6 GPa cristalul hexagonal suferă o tranziție de la faza hexagonală la faza monoclinică; și odată cu aceasta, deformarea octaedrelor CaO6 și straturile sale.
Morfologie
Cristalele de Ca (OH)Două Sunt hexagonale, dar acest lucru nu este un impediment pentru ei să adopte vreo morfologie. Unele dintre aceste structuri (cum ar fi firele, fulgii sau rocile) sunt mai poroase decât altele, robuste sau plane, ceea ce influențează direct aplicațiile lor finale..
Astfel, nu este același lucru să folosiți cristale din portlanditul mineral, decât să le sintetizați astfel încât să fie formate din nanoparticule unde sunt urmați câțiva parametri riguroși; cum ar fi gradul de hidratare, concentrația de CaO utilizat și timpul în care cristalul este lăsat să crească.
Proprietăți
Aspectul fizic
Solid alb, inodor, praf cu gust amar.
Masă molară
74,093 g / mol
Punct de topire
580 ° C. La această temperatură se descompune eliberând apă, deci nu ajunge niciodată la vaporizare:
Ca (OH)Două => CaO + HDouăSAU
Densitate
2.211 g / cm3
pH
O soluție apoasă saturată a acesteia are un pH de 12,4 la 25 ° C.
Solubilitatea apei
Solubilitatea Ca (OH)Două în apă scade odată cu creșterea temperaturii. De exemplu, la 0 ° C solubilitatea sa este de 1,89 g / L; în timp ce la 20 ° C și 100 ° C, acestea sunt de 1,73 g / L, respectiv 0,66 g / L.
Acest lucru indică un fapt termodinamic: hidratarea Ca (OH)Două este exoterm, deci respectând principiul lui Le Chatelier ecuația ar fi:
Ca (OH)Două <=> ACDouă+ + 2OH- + Î
Unde Q este căldura degajată. Cu cât apa este mai fierbinte, cu atât mai mult echilibru va tinde spre stânga; adică mai puțin Ca (OH) se va dizolvaDouă. Din acest motiv, în apa rece se dizolvă mult mai mult decât în apa clocotită..
Pe de altă parte, solubilitatea menționată crește dacă pH-ul devine acid, datorită neutralizării ionilor OH.- iar deplasarea echilibrului anterior spre dreapta. În timpul acestui proces se eliberează chiar mai multă căldură decât în apa neutră. Pe lângă soluțiile apoase acide, Ca (OH)Două este, de asemenea, solubil în glicerol.
Kps
5.5 10-6. Această valoare este considerată mică și este în concordanță cu solubilitatea redusă a Ca (OH)Două în apă (același echilibru ca mai sus).
Indicele de refracție
1.574
Stabilitate
Ca (OH)Două rămâne stabil atât timp cât nu este expus la CODouă din aer, deoarece îl absoarbe și formează carbonat de calciu, CaCO3. Prin urmare, începe să se contamineze într-un amestec solid de cristale de Ca (OH)Două-Hoţ3, unde există anioni CO3Două- concurând cu OH- pentru a interacționa cu CaDouă+:
Ca (OH)Două + CODouă => CaCO3 + HDouăSAU
De fapt, acesta este motivul pentru care soluțiile concentrate de Ca (OH)Două devin lăptoase, pe măsură ce apare o suspensie de particule de CaCO3.
Obținerea
Ca (OH)Două Se obține comercial prin reacția varului, CaO, cu un exces de apă de două până la trei ori:
CaO + HDouăO => Ca (OH)Două
Cu toate acestea, în proces poate apărea carbonizarea Ca (OH)Două, la fel cum s-a explicat mai sus.
Alte metode pentru obținerea acestuia sunt utilizarea sărurilor solubile de calciu, cum ar fi CaClDouă sau Ca (NR3)Două, și bazificați-le cu NaOH, astfel încât să precipite Ca (OH)Două. Prin controlul parametrilor precum volumele de apă, temperatura, pH-ul, solventul, gradul de carbonizare, timpul de maturare etc., se pot sintetiza nanoparticule cu morfologii diferite.
De asemenea, poate fi preparat prin selectarea materiilor prime naturale și regenerabile sau a deșeurilor dintr-o industrie, care sunt bogate în calciu, care atunci când sunt încălzite și prelucrate, cenușa lor va consta din var; iar de aici, din nou, se poate prepara Ca (OH)Două prin hidratarea acestor cenușe fără a fi nevoie de risipirea calcarului, CaCO3.
De exemplu, baga de agave a fost utilizată în acest scop, atribuind valoare adăugată deșeurilor din industriile de tequila..
Aplicații
Prelucrare alimentară

Hidroxidul de calciu este prezent în multe alimente în unele dintre etapele sale de preparare. De exemplu, murăturile, cum ar fi castraveții, sunt scufundate într-o soluție apoasă pentru a le face mai clare atunci când sunt ambalate în oțet. Acest lucru se datorează faptului că proteinele de pe suprafața sa absorb calciu din mediu..
La fel se întâmplă și cu boabele de porumb înainte de a le transforma în făină, deoarece ajută la eliberarea vitaminei B3 (niacină) și ușurează măcinarea. Calciul pe care îl furnizează este, de asemenea, utilizat pentru a adăuga valoare nutrițională anumitor sucuri.
Ca (OH)Două De asemenea, poate înlocui praful de copt în unele rețete de pâine și clarifica soluțiile zaharoase obținute din trestie de zahăr și sfeclă..
Dezinfectant pentru canalizare
Acțiunea clarificatoare a Ca (OH)Două Se datorează faptului că acționează ca un agent de floculare; adică crește dimensiunea particulelor suspendate până când formează flocuri, care ulterior se așează sau pot fi filtrate.
Această proprietate a fost utilizată pentru dezinfectarea apelor reziduale, destabilizând coloizii săi care sunt neplăcuți pentru vederea (și mirosul) spectatorilor..
Industria hârtiei
Ca (OH)Două este utilizat în procesul Kraft pentru a regenera NaOH utilizat pentru tratarea lemnului.
Absorbant de gaz
Ca (OH)Două folosit pentru a elimina CODouă a spațiilor închise sau în medii în care prezența lor este contraproductivă.
Îngrijire personală
În formulări pentru creme depilatoare Ca (OH)Două Se găsește tacit, deoarece elementalitatea sa ajută la slăbirea keratinei firelor de păr și, prin urmare, este mai ușor să le îndepărtați.
Constructie

Ca (OH)Două A fost prezent din timpuri imemoriale, integrând masele de tencuială și mortar utilizate în construcția lucrărilor arhitecturale egiptene, cum ar fi piramidele; de asemenea, clădiri, mausolee, pereți, scări, podele, suporturi și chiar pentru a reconstrui cimentul dentar.
Acțiunea sa fortificatoare se datorează faptului că atunci când "respirați" CODouă, cristalele rezultate de CaCO3 terminați integrarea nisipurilor și a celorlalte componente ale unor astfel de amestecuri într-un grad mai bun.
Riscuri și efecte secundare
Ca (OH)Două Nu este un solid puternic bazic în comparație cu alți hidroxizi, deși este mai mult decât Mg (OH)Două. Chiar și așa, în ciuda faptului că nu este reactiv sau inflamabil, elementalitatea sa este încă suficient de agresivă pentru a provoca arsuri minore..
Prin urmare, trebuie tratat cu respect, deoarece este capabil să irite ochii, limba și plămânii, precum și să declanșeze alte boli precum: pierderea vederii, alcalinizarea severă a sângelui, erupții cutanate, vărsături și dureri în gât.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Hidroxid de calciu. Recuperat de pe: en.wikipedia.org
- Chávez Guerrero și colab. (2016). Sinteza și caracterizarea hidroxidului de calciu obținut din baga de agave și investigarea activității sale antibacteriene. Recuperat de pe: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Structura cristalină a fazei de înaltă presiune a hidroxidului de calciu, portlandit: pulbere in situ și studiu de difracție cu raze X monocristal. Mineralog american; 98 (8-9): 1421-1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (05 iunie 2019). Hidroxid de calciu. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Aniruddha S. și colab. (2015). Sinteza hidroxidului de calciu nano în mediu apos. The American Ceramic Society. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12 aprilie 2018). Cum se utilizează hidroxidul de calciu în alimente și este sigur? Recuperat de pe: healthline.com
- Brian Clegg. (26 mai 2015). Hidroxid de calciu. Recuperat de pe: chemistryworld.com


Nimeni nu a comentat acest articol încă.