
Formula hidroxidului de litiu (LiOH), proprietăți, riscuri, utilizări
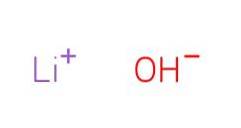
hidroxid de litiu Este un compus chimic cu formula LiOH (EMBL-EBI, 2008). Hidroxidul de litiu este un compus anorganic bazic. Este utilizat în mare măsură în sinteza organică pentru a promova reacția datorită bazicii sale puternice.
Hidroxidul de litiu nu se găsește în mod liber în natură. Este foarte reactiv și dacă ar fi în natură ar putea reacționa cu ușurință pentru a forma alți compuși. Cu toate acestea, unele hidroxizi de litiu / aluminiu care formează diverse amestecuri pot fi găsite în diferite minerale..
În 1950, izotopul Li-6 a fost folosit ca materie primă pentru a produce arme termonucleare, cum ar fi bomba cu hidrogen..
Din acel moment, industria energiei atomice din Statele Unite a început să utilizeze o cantitate mare de hidroxid de litiu, ducând la dezvoltarea surprinzătoare a industriei de litiu (Lithium hydroxide, 2016).
Majoritatea hidroxidului de litiu este produs din reacția dintre carbonatul de litiu și hidroxidul de calciu (Formula hidroxidului de litiu, S.F.). Această reacție produce hidroxid de litiu și, de asemenea, carbonat de calciu:
LiDouăCO3 + Ca (OH)Două → 2 LiOH + CaCO3
De asemenea, este preparat din reacția oxidului de litiu și a apei:
LiDouăO + HDouăO → 2LiOH
Hidroxidul de litiu a fost folosit ca absorbant de dioxid de carbon în submarin și sursă gonflabilă a balonului armatei în 1944.
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 3 utilizări
- 4 Referințe
Proprietati fizice si chimice
Hidroxidul de litiu sunt cristale albe fără o aromă caracteristică (National Center for Biotechnology Information., 2017). Aspectul său este prezentat în figura 2.

În soluție apoasă formează un lichid cristalin cu o aromă înțepătoare. Greutatea sa moleculară este de 23,91 g / mol. Există sub două forme: anhidru și monohidrat LiOH.H2O, care are o greutate moleculară de 41,96 g / lună. Compusul are o densitate de 1,46 g / ml pentru forma anhidră și 1,51 g / ml pentru forma monohidrat..
Punctele sale de topire și fierbere sunt de 462ºC și respectiv de 924ºC. Hidroxidul de litiu este singurul hidroxid alcalin care nu prezintă polimorfism, iar rețeaua sa are o structură tetragonală. Compusul este foarte solubil în apă și este ușor solubil în etanol (Royal Society of Chemistry, 2015).
Hidroxidul de litiu și ceilalți hidroxizi alcalini (NaOH, KOH, RbOH și CsOH) sunt foarte versatili de utilizat în sinteza organică deoarece sunt baze mai puternice care reacționează ușor..
Poate reacționa cu apă și dioxid de carbon la temperatura camerei. De asemenea, poate reacționa cu multe metale, cum ar fi Ag, Au, Cu și Pt, deci a fost un important material de pornire în sinteza organometalică..
Soluțiile de hidroxid de litiu neutralizează exoterm acizii pentru a forma săruri plus apă. Reacționează cu anumite metale (cum ar fi aluminiu și zinc) pentru a forma oxizi sau hidroxizi ai metalului și generează hidrogen gazos. Ele pot iniția reacții de polimerizare în compuși organici polimerizabili, în special epoxizi.
Poate genera gaze inflamabile și / sau toxice cu săruri de amoniu, nitruri, compuși organici halogenați, diverse metale, peroxizi și hidroperoxizi. Poate servi drept catalizator.
Reacționează atunci când este încălzit la peste 84 ° C cu soluții apoase de zaharuri reducătoare, altele decât zaharoza, pentru a dezvolta niveluri toxice de monoxid de carbon (CAMEO, 2016).
Reactivitate și pericole
Hidroxidul de litiu este un compus stabil, deși este incompatibil cu acizii puternici, dioxidul de carbon și umezeala. Substanța se descompune la încălzire (924 ° C), producând vapori toxici.
Soluția din apă este o bază puternică, reacționează violent cu acidul și este corozivă pentru aluminiu și zinc. Reacționează cu oxidanți.
Compusul este coroziv pentru ochi, piele, căile respiratorii și dacă este înghițit. Inhalarea substanței poate provoca edem pulmonar.
Simptomele edemului pulmonar nu apar adesea timp de câteva ore și sunt agravate de efortul fizic. Expunerea poate ucide. Efectele pot fi întârziate (Institutul Național pentru Securitate și Sănătate în Muncă, 2015).
Dacă compusul intră în contact cu ochii, lentilele de contact trebuie verificate și îndepărtate. Ochii trebuie spălați imediat cu multă apă timp de cel puțin 15 minute cu apă rece.
În caz de contact cu pielea, zona afectată trebuie clătită imediat timp de cel puțin 15 minute cu multă apă sau un acid slab, de exemplu oțet, în timp ce îndepărtați hainele și încălțămintea contaminate..
Acoperiți pielea iritată cu un emolient. Spălați hainele și încălțămintea înainte de refolosire. Dacă contactul este sever, spălați cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană.
În caz de inhalare, victima trebuie mutată într-un loc răcoros. Dacă nu respirați, se administrează respirație artificială. Dacă respirația este dificilă, dați oxigen.
Dacă compusul este înghițit, vărsăturile nu trebuie induse. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
În toate cazurile, trebuie acordată asistență medicală imediată (Fișa tehnică de securitate a hidroxidului de litiu, 21).
Aplicații
Hidroxidul de litiu este utilizat la fabricarea sărurilor de litiu (săpunurilor) de acizi stearici și alți acizi grași.
Aceste săpunuri sunt utilizate pe scară largă ca agenți de îngroșare în grăsimile lubrifiante pentru a îmbunătăți rezistența la căldură, rezistența la apă, stabilitatea și proprietățile mecanice. Aditivii pentru grăsimi pot fi folosiți la rulmenții pentru mașini, avioane și macarale etc..
Hidroxidul de litiu solid calcinat poate fi folosit ca absorbant de dioxid de carbon pentru membrii echipajului din nave spațiale și submarine.
Sonda spațială pentru proiectele NASA Mercury, Geminni și Apollo a folosit hidroxid de litiu ca absorbanți. Are o performanță fiabilă și poate absorbi cu ușurință dioxidul de carbon din vaporii de apă. Reacția chimică este:
2LiOH + CODouă → LiDouăCO3 + HDouăSAU.
1g hidroxid de litiu anhidru poate absorbi dioxidul de carbon cu un volum de 450ml. Doar 750 g de hidroxid de litiu anhidru pot absorbi dioxidul de carbon expirat de o persoană în fiecare zi.
Hidroxidul de litiu și alți compuși de litiu au fost folosiți recent pentru dezvoltarea și studiul bateriilor alcaline (ENCYCLOPÆDIA BRITANNICA, 2013).
Referințe
- CAMEE. (2016). HIDROXID DE LITIU, SOLUȚIE. Recuperat din cameochemicals.
- EMBL-EBI. (2008, 13 ianuarie). hidroxid de litiu. Recuperat de la ChEBI.
- ENCICLOPÆDIA BRITANNICA. (2013, 23 august). Litiu (Li). Recuperat de la britannica.
- Hidroxid de litiu. (2016). Recuperat de pe chemicalbook.com.
- Formula hidroxidului de litiu. (S.F.). Recuperat de pe softschools.com.
- Fișă tehnică de securitate hidroxid de litiu. (21 mai 2013). Recuperat de la sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 30 aprilie). Baza de date compusă PubChem; CID = 3939. Adus de la PubChem.
- Institutul Național pentru Securitate și Sănătate în Muncă. (2015, 22 iulie). HIDROXID DE LITIU. Recuperat de pe cdc.gov.
- Societatea Regală de Chimie. (2015). Hidroxid de litiu. Recuperat de la chemspider: chemspider.com.



Nimeni nu a comentat acest articol încă.