
Caracteristici isobare, exemple și diferențe cu izotopii

izobare Sunt acele specii atomice care au aceeași masă, dar care provin din elemente chimice diferite. În consecință, se poate spune că sunt alcătuite din diferite numere de protoni și neutroni.
Atât protonii, cât și neutronii se află în nucleul atomilor lor, dar numărul net de neutroni și protoni prezenți în fiecare nucleu rămâne același. Cu alte cuvinte, o specie de izobar provine atunci când o pereche de nuclei atomici prezintă același număr net de neutroni și protoni pentru fiecare specie..
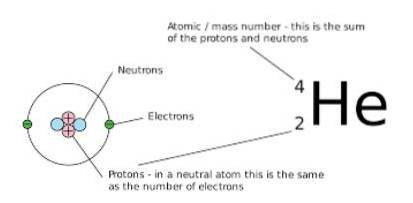
Cu toate acestea, numărul de neutroni și protoni care alcătuiesc acea cantitate netă este diferit. Un mod de a-l observa grafic este să observați numărul de masă (care este plasat în partea stângă sus a simbolului elementului chimic care este reprezentat), deoarece în izobare acest număr este același.
Indice articol
- 1 Caracteristici
- 1.1 Reprezentare
- 2 Exemple
- 3 Diferențe între izobare și izotopi
- 4 Referințe
Caracteristici
În primul rând, etimologia termenului isobarus provine din cuvintele grecești isos (care înseamnă „egal”) și baros (care înseamnă „greutate”), care se referă la egalitatea de greutate între ambele specii nucleare.
Trebuie remarcat faptul că izobarele au anumite asemănări cu alte specii ale căror nuclee au coincidențe, cum ar fi izotonele, care au același număr de neutroni, dar cu numere de masă și numere atomice diferite, cum ar fi perechile 13C și 14Nu 36S și 37Cl.
Pe de altă parte, termenul „nuclid” este numele care a fost inventat fiecărui set de nucleoni (structuri formate din neutroni și protoni) care pot fi formați.
Astfel, nuclizii se disting, eventual, prin numărul lor de neutroni sau protoni sau chiar prin cantitatea de energie deținută de structura conglomerării lor..
La fel, un nucleu fiică apare după procesul de descompunere β și acesta, la rândul său, este un izobar al nucleului părinte, deoarece numărul de nucleoni prezenți în nucleu rămâne neschimbat, spre deosebire de ceea ce se întâmplă prin decădere α.
Este important să ne amintim că izobarele diferite au numere atomice diferite, confirmând că sunt elemente chimice diferite..
Reprezentare
Pentru a desemna diferiții nuclizi, se folosește o notație specifică, care poate fi reprezentată în două moduri: una constă în plasarea numelui elementului chimic urmat de numărul său de masă, care sunt legate printr-o cratimă. De exemplu: azotul-14, al cărui nucleu este format din șapte neutroni și șapte protoni.
Cealaltă modalitate de reprezentare a acestor specii este plasarea simbolului elementului chimic, precedat de un supercript numeric care indică numărul de masă al atomului în cauză, precum și un indice numeric care desemnează numărul său atomic, după cum urmează:
ZLAX
În această expresie X reprezintă elementul chimic al atomului în cauză, A este numărul de masă (rezultatul adunării dintre numărul de neutroni și protoni) și Z reprezintă numărul atomic (egal cu numărul de protoni din nucleul atom).
Atunci când acești nuclizi sunt reprezentați, numărul atomic al atomului (Z) este de obicei omis deoarece nu furnizează date suplimentare relevante, deci este reprezentat frecvent ca LAX.
O modalitate de a arăta această notație este luând exemplul anterior (azot-14), care este, de asemenea, notat ca 14N. Aceasta este notația utilizată pentru izobarele.
Exemple
Utilizarea expresiei „izobar” pentru speciile cunoscute sub numele de nuclizi care au același număr de nucleoni (număr egal de masă) a fost propusă la sfârșitul anilor 1910 de către chimistul britanic Alfred Walter Stewart..
În această ordine de idei, un exemplu de izobar poate fi observat în cazul speciei 14C și 14N: numărul de masă este egal cu 14, ceea ce implică faptul că numărul de protoni și neutroni din ambele specii este diferit.
Într-adevăr, acest atom de carbon are un număr atomic egal cu 6, deci există 6 protoni în structura sa, iar la rândul său are 8 neutroni în nucleul său. Deci numărul său de masă este 14 (6 + 8 = 14).
La rândul său, atomul de azot are un număr atomic egal cu 7, deci este alcătuit din 7 protoni, dar are și 7 neutroni în nucleul său. Numărul său de masă este, de asemenea, 14 (7 + 7 = 14).
De asemenea, puteți găsi o serie în care toți atomii au un număr de masă egal cu 40; acesta este cazul izobarelor: 40AC, 40K, 40Ar, 40Cl și 40S.
Diferențele dintre izobare și izotopi
După cum s-a explicat anterior, nuclizii descriu diferitele clase de nuclei atomici care există, în funcție de numărul de protoni și neutroni pe care îl au..
De asemenea, printre aceste tipuri de nuclizi se numără izobarele și izotopii, care vor fi diferențiați mai jos.
În cazul izobarelor, așa cum s-a menționat anterior, acestea au același număr de nucleoni - adică același număr de masă -, unde numărul de protoni cu care o specie este mai mare decât cealaltă este de acord cu numărul de neutroni. sunt deficitare, deci totalul este același. Cu toate acestea, numărul său atomic este diferit.
În acest sens, speciile izobare provin din diferite elemente chimice, deci sunt situate în spații diferite ale tabelului periodic și au caracteristici și proprietăți specifice diferite..
Pe de altă parte, în cazul izotopilor, se întâmplă opusul, deoarece aceștia au același număr atomic, dar cantități diferite de masă; adică au același număr de protoni, dar un număr diferit de neutroni în interiorul nucleilor lor atomici..
În plus, izotopii sunt specii atomice aparținând acelorași elemente, deci sunt situate în același spațiu al tabelului periodic și au caracteristici și proprietăți similare..
Referințe
- Wikipedia. (s.f.). Izobar (nuclid). Recuperat de pe en.wikipedia.org
- Britannica, E. (s.f.). Isobar. Adus de la britannica.com
- Konya, J. și Nagy, N. M. (2018). Nucleare și Radiochimie. Recuperat de pe books.google.co.ve
- Educație energetică. (s.f.). Isobar (nuclear). Adus de la energyeducation.ca
- Vizualizare Tutor. (s.f.). Nucleii. Recuperat de la physics.tutorvista.com

Nimeni nu a comentat acest articol încă.