
Joseph Thomson Biografie și contribuții la știință și chimie
Joseph John Thomson El a fost un chimist remarcabil pentru diverse contribuții, cum ar fi descoperirea electronului, modelul său atomic, descoperirea izotopilor sau experimentul cu raze catodice.
S-a născut în Cheetam Hill, un district din Manchester, Anglia, la 18 decembrie 1856. Cunoscut și sub numele de „J.J.” Thomson, a studiat ingineria la Owens College, care acum face parte din Universitatea din Manchester, iar mai târziu matematică la Cambridge.

În 1890, J. J. Thomson s-a căsătorit cu Rose Elizabeth Paget, fiica medicului Sir Edward George Paget, cu care a avut doi copii: o fată, pe nume Joan Paget Thomson, și un băiat, George Paget Thomson..
Acesta din urmă avea să devină un cunoscut om de știință, obținând în 1937 un Premiu Nobel pentru fizică pentru munca sa cu electronii..
Încă de la o vârstă fragedă, Thomson și-a concentrat studiile asupra structurii atomilor, descoperind astfel existența electronilor și a izotopilor, printre multe alte contribuții..
În 1906, Thomson a primit Premiul Nobel pentru fizică, „ca recunoaștere a marelui merit al cercetărilor sale teoretice și experimentale privind conducerea electricității prin gaze”, printre multe alte premii pentru munca sa. (1)
În 1908, a fost numit cavaler de coroana britanică și a servit ca profesor onorific de fizică la Cambridge și la Royal Institute, Londra..
A murit la 30 august 1940, la vârsta de 83 de ani, în orașul Cambridge, Regatul Unit. Fizicianul a fost înmormântat în Westminster Abbey, lângă mormântul lui Sir Isaac Newton. (Două)
Indice articol
- 1 Principalele contribuții ale lui Thomson la știință
- 1.1 Descoperirea electronului
- 1.2 Modelul atomic al lui Thomson
- 1.3 Separarea atomilor
- 1.4 Descoperirea izotopilor
- 1.5 Experimente cu raze catodice
- 1.6 Spectrometru de masă
- 2 Moștenirea lui Thomson
- 3 Lucrări remarcabile
- 4 Referințe
Principalele contribuții ale lui Thomson la știință
Descoperirea electronului
În 1897, J.J. Thomson a descoperit o nouă particulă mai ușoară decât hidrogenul, care a fost numită „electron”.
Hidrogenul a fost considerat o unitate de măsură pentru greutatea atomică. Până în acel moment, atomul era cea mai mică diviziune a materiei.
În acest sens, Thomson a fost primul care a descoperit particule subatomice corpusculare încărcate negativ.
Modelul atomic al lui Thomson
Modelul atomic al lui Thomson a fost structura pe care fizicianul englez a atribuit-o atomilor. Pentru omul de știință, atomii erau o sferă de sarcină pozitivă.
Acolo au fost încorporați electronii de sarcină negativă, distribuiți uniform pe acel nor de sarcină pozitivă, adică neutralizează sarcina pozitivă a masei atomului..
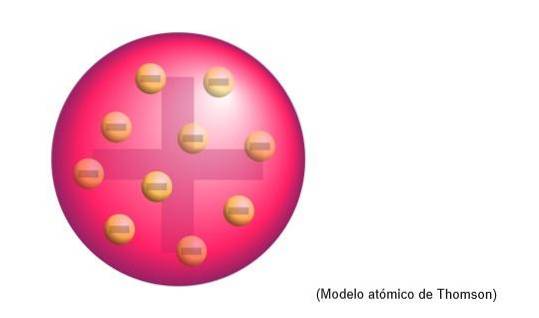
Acest nou model îl înlocuiește pe cel dezvoltat de Dalton și va fi ulterior respins de Rutherford, un discipol al lui Thomson la Cavendish Laboratories, Cambridge..
Separarea atomului
Thomson a folosit raze pozitive sau anodice pentru a separa atomii de diferite mase. Această metodă i-a permis să calculeze electricitatea transportată de fiecare atom și numărul de molecule pe centimetru cub..
Fiind capabil să împartă atomi de masă și sarcină diferite, fizicianul a descoperit existența izotopilor. Tot în acest fel, cu studiul său asupra razelor pozitive, a produs un mare avans spre spectrometria de masă..
Descoperirea izotopilor
J.J. Thomson a descoperit că ionii de neon aveau mase diferite, adică greutăți atomice diferite. Astfel Thomson a arătat că neonul are două subtipuri de izotopi, neon-20 și neon-22..
Izotopii, studiați până în prezent, sunt atomi ai aceluiași element, dar nucleii lor au numere de masă diferite, deoarece sunt compuși din cantități diferite de neutroni în centrul lor..
Experimente cu raze catodice
Razele catodice sunt curenți de electroni în tuburile de vid, adică tuburi de sticlă cu doi electrozi, unul pozitiv și unul negativ..
Când electrodul negativ, sau numit și catodul, este încălzit, acesta emite radiații care sunt direcționate către electrodul pozitiv sau anod, în linie dreaptă, dacă nu există câmp magnetic în acea cale.
Dacă pereții de sticlă ai tubului sunt acoperiți cu material fluorescent, lovirea catodilor împotriva stratului respectiv produce proiecția luminii.
Thomson a studiat comportamentul razelor catodice și a ajuns la concluziile că razele călătoreau în linie dreaptă.
De asemenea, faptul că aceste raze ar putea fi deviate de la traiectoria lor prin prezența unui magnet, adică a unui câmp magnetic. În plus, razele ar putea mișca lamele cu forța masei electronilor circulanți, demonstrând astfel că electronii aveau masă..
J.J. Thomson a experimentat modificarea gazului din tubul catodic, dar nu a modificat comportamentul electronilor. De asemenea, razele catodice încălzeau obiecte care se aflau în calea dintre electrozi..
În concluzie, Thomson a arătat că razele catodice au efecte luminoase, mecanice, chimice și termice..
Tuburile cu raze catodice și proprietățile lor de lumină au fost transcendentale pentru invenția ulterioară a televiziunii cu tub (CTR) și a camerelor video..
Spectrometru de masă
J.J. Thomson a creat o primă abordare a Spectrometru de masă. Acest instrument i-a permis omului de știință să studieze relația masă / încărcare a tuburilor catodice și să măsoare cât deviază din cauza influenței unui câmp magnetic și a cantității de energie pe care o transportă..
Cu această cercetare a ajuns la concluzia că razele catodice erau compuse din corpusculi încărcați negativ, care sunt în interiorul atomilor, postulând astfel divizibilitatea atomului și dând naștere la figura electronului..
La fel, progresele în spectrometria de masă au continuat până astăzi, evoluând în diferite metode pentru a separa electronii de atomi..
Mai mult, Thomson a fost primul care a sugerat primul ghid de val în 1893. Acest experiment a constat în propagarea undelor electromagnetice într-o cavitate cilindrică controlată, care a fost efectuată pentru prima dată în 1897 de Lord Rayleigh, un alt laureat al Premiului Nobel pentru fizică..
Ghidurile de undă ar fi utilizate pe scară largă în viitor, chiar și astăzi cu transmisie de date și fibră optică.
Moștenirea lui Thomson
Thomson (Th) a fost stabilit ca o unitate de măsură de masă-sarcină în spectrometrie de masă, propusă de chimiștii Cooks și Rockwood, în onoarea lui Thomson..
Această tehnică permite să se determine distribuția moleculelor unei substanțe în funcție de masa lor și, prin aceasta, să recunoască care sunt prezente într-un eșantion de materie..
Formula lui Thomson (Th):
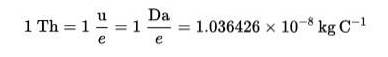
Lucrări remarcabile
- Descărcarea electricității prin gaze, conducerea electricității prin gaze (1900).
- Teoria corpusculară a materiei, electronul în chimie și amintiri și reflecții (1907).
- Dincolo de electron (1928).
Referințe
- Nobel Media AB (2014). J. Thomson - Biografic. Nobelprize.org. nobelprize.org.
- Thomson, Joseph J.., Conducerea electricității prin gaze. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Farmecul discret al particulelor elementare.
- Christen, Hans Rudolf, Fundamentele chimiei generale și anorganice, volumul 1. Barcelona, Spania. Ediciones Reverté S.A., 1986.
- Arzani, Aurora Cortina, Chimie elementară generală. Mexic, Editorial Porrúa, 1967.
- R. G. Cooks, A. L. Rockwood. Rapid Commun. Spectrul de masă. 5, 93 (1991).



Nimeni nu a comentat acest articol încă.