
Istoria legii Boyle-Mariotte, expresie, exemple
Legea Boyle-Mariotte Este una care exprimă relația dintre presiunea exercitată de sau asupra unui gaz și volumul pe care îl ocupă; menținând atât temperatura gazului constantă, cât și cantitatea sa (numărul de moli).
Această lege, împreună cu cea a lui Charles, Gay-Lussac, Charles și Avogadro, descrie comportamentul unui gaz ideal; în mod specific, într-un container închis supus unor schimbări de volum exercitate de o forță mecanică.
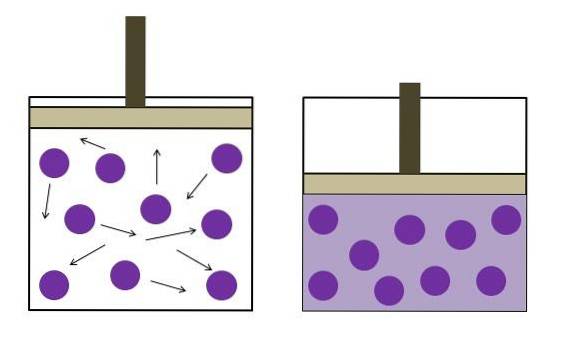
Imaginea de mai sus rezumă pe scurt legea Boyle-Mariotte.
Punctele violete reprezintă molecule de gaz sau atomi, care se ciocnesc cu pereții interiori ai containerului (stânga). Pe măsură ce spațiul disponibil sau volumul containerului ocupat de acest gaz scade, coliziile cresc, ceea ce se traduce printr-o creștere a presiunii (dreapta).
Aceasta arată că presiunea P și volumul V al gazului sunt invers proporționale dacă recipientul este închis ermetic; în caz contrar, o presiune mai mare ar echivala cu o expansiune mai mare a vasului.
Dacă s-ar face un grafic V împotriva lui P, cu datele lui V și P pe axele Y și respectiv X, s-ar observa o curbă asimptotică. Cu cât V este mai mic, cu atât crește P; adică curba se va extinde spre valori mari ale lui P pe axa X..
Desigur, temperatura rămâne constantă; dar, dacă același experiment s-ar desfășura la temperaturi diferite, pozițiile relative ale acestor curbe V vs P s-ar schimba pe axa carteziană. Schimbarea ar fi și mai evidentă dacă ar fi reprezentată pe o axă tridimensională, cu T constantă pe axa Z..
Indice articol
- 1 Istoria legii lui Boyle
- 1.1 Context
- 1.2 Experimentul cu mercur
- 1.3 Edme Mariotte
- 1.4 Consolidarea legii
- 2 Ce este această lege?
- 3 Expresia matematică
- 4 Pentru ce este? Ce probleme rezolvă legea Boyle?
- 4.1 Motoare cu abur
- 4.2 Sorbind băuturi
- 4.3 Sistemul respirator
- 5 Exemple (experimente)
- 5.1 Experimentul 1
- 5.2 Experimentul 2
- 6 Referințe
Istoria legii lui Boyle
fundal
De când savantul Galileo Galilei și-a exprimat credința în existența unui vid (1638), oamenii de știință au început să studieze proprietățile aerului și golurile parțiale.
Chimistul anglo-irlandez, Robert Boyle, și-a început studiul proprietăților aerului în 1638, aflând că Otto von Guericke, inginer și fizician german, a construit o pompă de aer..
Experiment cu mercur
Pentru a-și desfășura studiile asupra presiunii aerului, Boyle a folosit un tub de sticlă în formă de „J”, a cărui construcție a fost atribuită lui Robert Hooke, un asistent al lui Boyle. Capătul brațului scurt a fost sigilat, în timp ce capătul brațului lung al tubului a fost deschis pentru a plasa mercurul.
De la început, Boyle a dorit să studieze elasticitatea aerului, calitativ și cantitativ. Turnând mercur prin capătul deschis al tubului „J”, Boyle a dedus că aerul din brațul scurt al tubului se contracta sub presiunea mercurului..
Rezultate
Cu cât este mai mare cantitatea de mercur adăugată tubului, cu atât este mai mare presiunea exercitată asupra aerului și cu atât este mai mic volumul acestuia. Boyle a obținut un grafic de tip exponențial negativ al volumului de aer în funcție de presiune.
Între timp, dacă volumul de aer este reprezentat în funcție de inversul presiunii, avem o linie dreaptă cu o pantă pozitivă.
În 1662, Boyle a publicat prima lege fizică care a fost dată sub forma unei ecuații, care indica dependența funcțională a două variabile. În acest caz, presiunea și volumul.
Boyle a subliniat că există o relație inversă între presiunea exercitată asupra unui gaz și volumul pe care gazul îl ocupa, această relație fiind relativ adevărată pentru gazele reale. Majoritatea gazelor se comportă ca gaze ideale la temperaturi și presiuni moderate.
Pe măsură ce au apărut presiuni mai mari și temperaturi mai scăzute, deviațiile în comportamentul gazelor reale de la idealuri au devenit mai vizibile.
Edme mariotte
Fizicianul francez Edme Mariotte (1620-1684) a descoperit independent aceeași lege în 1679. Dar a avut meritul de a arăta că volumul variază în funcție de temperatură. De aceea se numește Legea lui Mariotte sau Legea lui Boyle și Mariotte..
Întărirea legii
Daniel Bernoulli (1737) a întărit Legea lui Boyle subliniind că presiunea unui gaz este produsă de impactul particulelor de gaz pe pereții containerului care îl conține..
În 1845, John Waterston a publicat un articol științific, în care s-a concentrat asupra principiilor principale ale teoriei cinetice a gazelor..
Mai târziu, Rudolf Clausius, James Maxwell și Ludqwig Boltzmann au consolidat teoria cinetică a gazelor, care raportează presiunea exercitată de un gaz cu viteza particulelor de gaz în mișcare..
Cu cât volumul containerului care conține un gaz este mai mic, cu atât este mai mare frecvența impacturilor particulelor care îl formează împotriva pereților containerului; și, prin urmare, cu cât este mai mare presiunea exercitată de gaz.
Ce este această lege?
Experimentele efectuate de Boyle indică faptul că există o relație inversă între volumul ocupat de un gaz și presiunea exercitată asupra acestuia. Cu toate acestea, relația indicată nu este total liniară, așa cum este indicat de un grafic al variației volumului în funcție de presiunea atribuită lui Boyle.
Legea lui Boyle indică faptul că volumul ocupat de un gaz este invers proporțional cu presiunea. De asemenea, se indică faptul că produsul presiunii unui gaz și volumul acestuia sunt constante.
Expresia matematică
Pentru a ajunge la expresia matematică a legii Boyle-Mariotte, pornim de la:
V ∝ 1 / P
Unde indică faptul că volumul ocupat de un gaz este invers proporțional cu presiunea acestuia. Cu toate acestea, există o constantă care dictează cât de invers este proporțională această relație.
V = k / P
Unde k este constanta proporționalității. Rezolvând pentru k avem:
VP = k
Produsul presiunii unui gaz și volumul acestuia sunt constante. Atunci:
V1P1 = k și VDouăPDouă = k
Și din aceasta se poate deduce că:
V1P1 = VDouăPDouă
Aceasta din urmă este expresia sau ecuația finală pentru legea lui Boyle.
Pentru ce este? Ce probleme rezolvă legea Boyle?
Motoare cu aburi

Legea Boyle-Mariotte se aplică în funcționarea motoarelor cu aburi. Este un motor cu ardere externă care folosește transformarea energiei termice a unei cantități de apă în energie mecanică.
Apa este încălzită într-un cazan închis ermetic, iar aburul produs exercită o presiune conform legii Boyle-Mariote care produce o expansiune a volumului unui cilindru prin împingerea unui piston.
Mișcarea liniară a pistonului se transformă într-o mișcare de rotație, prin utilizarea unui sistem de biele și manivele, care poate acționa roțile unei locomotive sau rotorul unui generator electric..
În prezent, motorul alternativ cu aburi este un motor puțin folosit, deoarece a fost deplasat de motorul electric și de motorul cu ardere internă din vehiculele de transport.
Beți băuturi
Acțiunea de a aspira o băutură răcoritoare sau un suc dintr-o sticlă printr-un tub de plastic este legată de legea Boyle-Mariotte. Când aerul este aspirat din tub folosind gura, există o scădere a presiunii în interiorul tubului.
Această scădere de presiune facilitează mișcarea ascendentă a lichidului în tub, permițând ingestia acestuia. Același principiu funcționează la extragerea sângelui prin utilizarea unei seringi..
Sistemul respirator
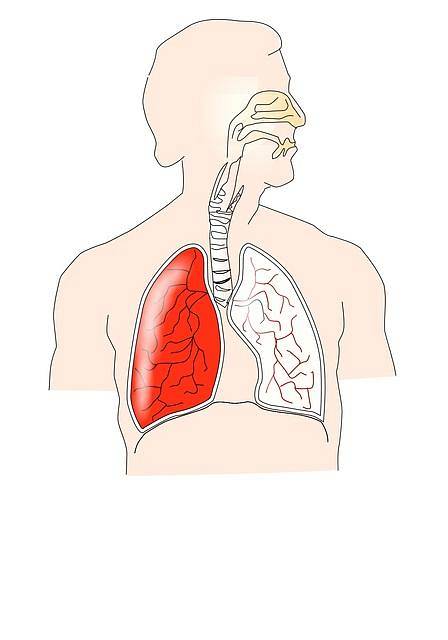
Legea Boyle-Mariotte este strâns legată de funcționarea sistemului respirator. În timpul fazei de inspirație, diafragma și alți mușchi se contractă; de exemplu, intercostalii externi care produc o expansiune a cutiei toracice.
Acest lucru determină o scădere a presiunii intrapleurale, provocând o expansiune pulmonară care produce o creștere a volumului pulmonar. Prin urmare, presiunea intrapulmonară scade conform legii Boyle-Mariotte.
Pe măsură ce presiunea intrapulmonară devine subatmosferică, aerul atmosferic curge în plămâni, provocând o creștere a presiunii în plămâni; echivalând astfel presiunea sa cu presiunea atmosferică și încheind faza de inspirație.
Ulterior, mușchii inspiratori se relaxează și mușchii expiratori se contractă. În plus, are loc retragerea elastică a plămânilor, fenomen care produce o scădere a volumului pulmonar, cu o creștere consecventă a presiunii intrapulmonare, explicată de legea Boyle-Mariotte..
Pe măsură ce presiunea intrapulmonară crește și devine mai mare decât presiunea atmosferică, aerul curge din interiorul plămânilor în atmosferă. Acest lucru se întâmplă până când presiunile se egalizează, ceea ce încheie faza de expirare..
Exemple (experimente)
Experimentul 1
Se plasează un mic balon închis ermetic, făcând un nod în gură, în interiorul unei seringi, din care a fost retras pistonul, de aproximativ 20 ml. Pistonul seringii este plasat spre mijlocul seringii, acul este retras și intrarea aerului este obstrucționată.
Observare
Trăgând încet pistonul injectorului, se observă că balonul se umflă.
Explicaţie
Două presiuni sunt exercitate pe peretele balonului: o presiune pe fața sa interioară, un produs al aerului conținut în interiorul balonului și o altă presiune pe fața exterioară a balonului, exercitată de aerul conținut în seringă..
Tragerea pistonului injectorului creează un vid în interior. Prin urmare, presiunea aerului pe fața exterioară a peretelui pompei scade, făcând presiunea exercitată în interiorul pompei relativ mai mare..
Această presiune netă, conform legii Boyle-Mariote, va produce o distensie a peretelui balonului și o creștere a volumului balonului..
Experimentul 2
O sticlă de plastic este tăiată aproximativ în jumătate, asigurându-se că tăierea este cât mai orizontală posibil. Un balon bine fixat este plasat în gura sticlei, în același timp o anumită cantitate de apă este plasată într-o farfurie adâncă.
Observare
Așezând fundul sticlei cu balonul peste apa din vas, balonul se umflă moderat.
Explicaţie
Apa deplasează o anumită cantitate de aer, crescând presiunea aerului pe peretele sticlei și pe interiorul balonului. Acest lucru determină, conform legii Boyle-Mariotte, o creștere a volumului balonului, care este vizualizată de umflarea balonului..
Referințe
- Wikipedia. (2019). Legea lui Boyle. Recuperat de pe: en.wikipedia.org
- Editorii Enciclopediei Britanice. (27 iulie 2018). Legea lui Boyle. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Helmenstine, Todd. (5 decembrie 2018). Formula pentru legea lui Boyle. Recuperat de pe: thoughtco.com
- Young Indian Films. (15 mai 2018). Legea lui Boyle: Experiment științific pentru copii. Recuperat de pe: yifindia.com
- Cecilia Bembibre. (22 mai 2011). Balon cu aer cald. Definiție ABC. Recuperat de pe: definicionabc.com
- Ganong, W, F. (2003). Fiziologie medicală. (Ediția a 19-a). Editorial Manualul modern.

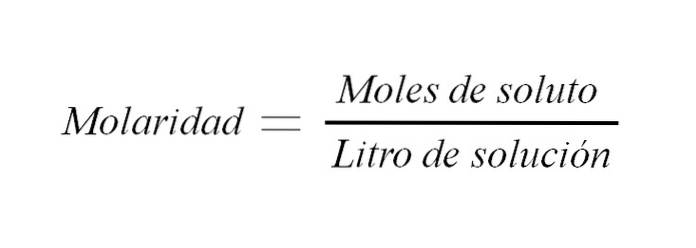

Nimeni nu a comentat acest articol încă.