
Povestiri, declarații și exemple de drept Ritchter-Wenzel

Legea Ritchter-Wenzel sau a proporțiilor reciproce este una care stabilește că proporțiile de masă dintre doi compuși fac posibilă determinarea celui al unui al treilea compus. Este una dintre legile stoichiometriei, alături de legea lui Lavoisier (legea conservării masei); Legea lui Proust (legea proporțiilor definite); și legea lui Dalton (legea proporțiilor multiple).
Ritcher și-a enunțat legea în 1792 într-o carte care a definit fundamentele stoichiometriei, pe baza lucrărilor de cercetare ale lui Carl F Wenzel, care în 1777 a publicat primul tabel de echivalență pentru acizi și baze..
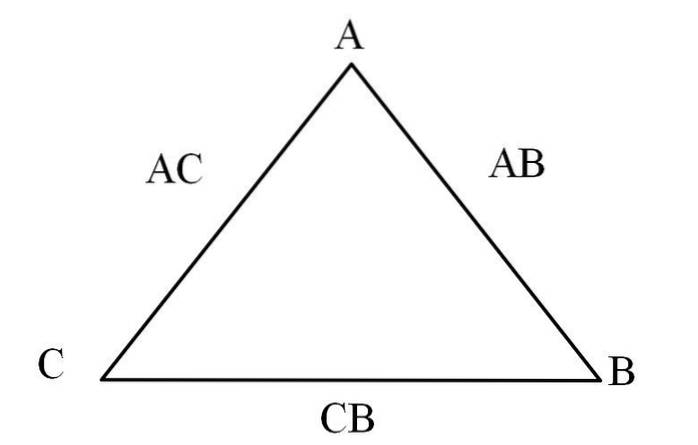
O modalitate simplă de a-l vizualiza este printr-un „triunghi al reciprocității” (imaginea de mai sus). Dacă cunoașteți masele A, C și B care se amestecă pentru a forma compușii AC și AB, puteți determina cât de mult din C și B se amestecă sau reacționează pentru a forma compusul CB.
În compușii AC și AB, elementul A este prezent în ambii, astfel încât împărțirea proporțiilor lor de masă va afla cât de mult reacționează C cu B.
Indice articol
- 1 Istoria și generalitățile legii proporțiilor reciproce
- 2 Declarații și consecințe
- 3 Exemple
- 3.1 Clorură de calciu
- 3.2 Oxizi de sulf
- 3.3 Sulfură și oxid de fier
- 4 Referințe
Istoria și generalitățile legii proporțiilor reciproce
Richter a descoperit că raportul în greutate al compușilor consumați într-o reacție chimică este întotdeauna același.
În acest sens, Ritcher a constatat că 615 părți în greutate de magnezie (MgO) sunt necesare, de exemplu, pentru a neutraliza 1000 de părți în greutate de acid sulfuric.
Între 1792 și 1794, Ritcher a publicat un rezumat în trei volume care conține lucrarea sa despre legea proporțiilor definite. Rezumatul a tratat stoichiometria, definindu-l ca fiind arta măsurătorilor chimice..
Observând, în plus, că stoichiometria se ocupă de legile conform cărora substanțele se unesc pentru a forma compuși. Cu toate acestea, munca de cercetare a lui Richter a fost criticată pentru tratamentul matematic pe care l-a folosit și s-a subliniat chiar că și-a ajustat rezultatele.
În 1802, Ernst Gottfried Fischer a publicat primul tabel al echivalenților chimici, care folosea acid sulfuric cu cifra de 1000; similar cu valoarea găsită de Richter, pentru neutralizarea acidului sulfuric de către magnezie.
Cu toate acestea, s-a observat că Richter a construit un tabel cu greutăți combinate care indica viteza la care au reacționat un număr de compuși. De exemplu, se afirmă că 859 părți de NaOH neutralizează 712 părți de HNO3.
Declarații și consecințe
Afirmația legii Richter-Wenzel este următoarea: masele a două elemente diferite care sunt combinate cu aceeași cantitate dintr-un al treilea element, păstrează aceeași relație ca masele acelor elemente atunci când sunt combinate între ele..
Această lege a permis stabilirea greutății echivalente sau a greutății echivalente-gram, ca cantitate de element sau compus care va reacționa cu o cantitate fixă dintr-o substanță de referință..
Richter a numit greutăți combinate în raport cu greutățile elementelor care s-au combinat cu fiecare gram de hidrogen. Ponderile relative ale combinației lui Richter corespund celor cunoscute în prezent ca greutate echivalentă a elementelor sau compușilor.
În conformitate cu abordarea anterioară, legea Richter-Wenzel poate fi enunțată după cum urmează:
Ponderile combinate ale diferitelor elemente care sunt combinate cu o greutate dată a unui element dat sunt ponderile relative ale combinației acelor elemente atunci când sunt combinate între ele sau multipli sau submultipli ai acestor relații de cantitate.
Exemple
Clorura de calciu
În oxidul de calciu (CaO), 40 g de calciu se combină cu 16 g de oxigen (O). Între timp, în oxid hipocloros (ClDouăO), 71 g de clor sunt combinate cu 16 g de oxigen. Ce compus ar face calciu dacă este combinat cu clor?
Folosind triunghiul reciprocității, oxigenul este elementul comun pentru cei doi compuși. Proporțiile de masă ale celor două oxigenate sunt mai întâi determinate:
40g Ca / 16 gO = 5g Ca / 2g O
71g Cl / 16g O
Și acum împărțind cele două proporții de masă ale CaO și ClDouăSau vom avea:
(5g Ca / 2g O) / (71g Cl / 16g O) = 80g Ca / 142g Cl = 40g Ca / 71g Cl
Rețineți că legea proporțiilor de masă este îndeplinită: 40 g de calciu reacționează cu 71 g de clor.
Oxizi de sulf
Oxigenul și sulful reacționează cu cuprul pentru a da oxid de cupru (CuO) și, respectiv, sulfură de cupru (CuS). Cât de mult sulf ar reacționa cu oxigenul?
În oxidul de cupru, 63,5 g de cupru sunt combinate cu 16 g de oxigen. În sulfura de cupru, 63,5 g de cupru se leagă de 32 g de sulf. Împărțind proporțiile de masă avem:
(63,5g Cu / 16g O) / (63,5g Cu / 32g S) = 2032g S / 1016g O = 2g S / 1g O
Raportul de masă 2: 1 este multiplu de 4 (63,5 / 16), ceea ce arată că legea lui Richter este adevărată. Cu această proporție, SO, se obține monoxid de sulf (32 g de sulf reacționează cu 16 g de oxigen).
Dacă împărțiți acest raport la doi, veți obține 1: 1. Din nou, acum este un multiplu de 4 sau 2 și, prin urmare, este vorba despre SODouă, dioxid de sulf (32g de sulf reacționează cu 32g de oxigen).
Sulfură și oxid de fier
Sulfura de fier (FeS), în care 32 g de sulf este combinată cu 56 g de fier, reacționează cu oxid feros (FeO), în care 16 g de oxigen sunt combinate cu 56 g de fier. Acest articol servește drept referință.
În compușii care reacționează FeS și FeO, sulful (S) și oxigenul (O) în raport cu fierul (Fe) se găsesc în raportul 2: 1. În oxidul de sulf (SO), 32 g de sulf sunt combinate cu 16 g de oxigen, astfel încât sulful și oxigenul se află în raportul 2: 1.
Acest lucru indică faptul că legea proporțiilor reciproce sau legea lui Richter este îndeplinită.
Raportul găsit între sulf și oxigen în oxidul de sulf (2: 1), ar putea fi utilizat, de exemplu, pentru a calcula cât de mult oxigen reacționează cu 15 g de sulf.
g de oxigen = (15g de S) ∙ (1g de O / 2g de S) = 7,5g
Referințe
- Foist L. (2019). Legea proporției reciproce: definiție și exemple. Studiu. Recuperat de la: study.com
- Sarcini cibernetice. (2016, 9 februarie). Legea proporțiilor reciproce sau Richter-Wenzel. Recuperat din: cibertareas.infol
- Wikipedia. (2018). Legea proporțiilor reciproce. Recuperat de pe: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter și legea proporțiilor reciproce.-II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18 iunie 2015). Legea proporțiilor reciproce. Libretexturi de chimie. Recuperat de pe: chem.libretexts.org
- Redefinirea cunoștințelor. (29 iulie 2017). Legea proporțiilor reciproce. Recuperat de pe: hemantmore.org.in



Nimeni nu a comentat acest articol încă.