
Structura, proprietățile, utilizările, riscurile azotatului de sodiu (NaNO3)

nitrat de sodiu este un solid anorganic cristalin format dintr-un ion de sodiu Na+ și un ion nitrat NO3-. Formula sa chimică este NaNO3. În natură, acesta se găsește sub formă de nitratină minerală sau nitratit, care se găsește din abundență în deșertul Atacama din Chile, motiv pentru care acest mineral este, de asemenea, numit salpetru chilian sau caliche.
Azotatul de sodiu este un solid necombustibil, dar poate accelera oxidarea sau arderea materialelor inflamabile. Din acest motiv, este utilizat pe scară largă în artificii, explozivi, chibrituri, cărămizi de cărbune și unele tipuri de pesticide, pentru a ucide rozătoarele și alte mamifere mici..

Capacitatea de a promova arderea sau aprinderea altor materiale înseamnă că trebuie manipulată cu mare prudență. Dacă este expus la flăcări sau incendii, acesta poate exploda. În ciuda acestui fapt, NaNO3 Este folosit în industria alimentară deoarece are proprietăți conservante, în special pentru carne și pentru unele tipuri de brânzeturi..
Cu toate acestea, ingestia sa în exces poate provoca probleme de sănătate, în special la femeile însărcinate, bebeluși și copii. Prin transformarea în nitriți în sistemul digestiv, poate provoca anumite boli.
Indice articol
- 1 Structura chimică
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3,7 pH
- 3.8 Alte proprietăți
- 4 Obținerea
- 4.1 Prezența în corpul uman
- 5 utilizări
- 5.1 În industria alimentară
- 5.2 În îngrășăminte
- 5.3 Ca promotor sau facilitator al arderii sau exploziei
- 5.4 Eliminarea rozătoarelor și a altor mamifere
- 5.5 La prepararea altor compuși
- 5.6 La extragerea metalelor din deșeurile electronice
- 5.7 În cercetarea sănătății și exercițiilor fizice
- 5.8 În diverse utilizări
- 6 Riscuri
- 6.1 Pericole de manipulare
- 6.2 Probleme legate de ingestia acestuia cu alimente sau apă
- 7 Azotatul de sodiu din alimente
- 8 Referințe
Structura chimică
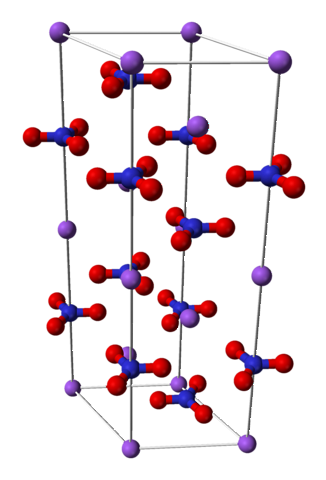
Azotatul de sodiu este alcătuit dintr-un cation Na de sodiu+ și un anion nitrat NO3-.
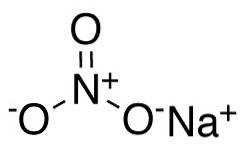
În anionul nitrat NO3- azotul N are o valență de +5 iar oxigenul o valență de -2. Din acest motiv, anionul nitrat are o sarcină negativă..
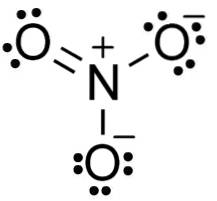
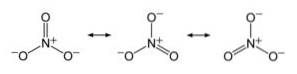
Anionul NU3- are o structură plană și simetrică, în care cei trei oxigeni distribuie sarcina negativă în mod egal sau uniform.
Nomenclatură
-Nitrat de sodiu
-Nitrat de sodiu
-Saltpeter de sodiu (din engleză sare de sodiu)
-Nitro soda (din engleza sodă azotată)
-Saltpeter din Chile
-Nitrat din Chile
-Nitratina
-Nitratit
-Caliche
Proprietăți

Starea fizică
Cristale solide, trigonale sau romboedrice incolore până la albe.
Greutate moleculară
84,995 g / mol
Punct de topire
308 ºC
Punct de fierbere
380 ºC (se descompune).
Densitate
2.257 g / cm3 la 20 ° C.
Solubilitate
Solubil în apă: 91,2 g / 100 g de apă la 25 ° C sau 1 g în 1,1 mL de apă. Ușor solubil în etanol și metanol.
pH
Soluțiile de azotat de sodiu sunt neutre, adică nici acide, nici bazice, de aceea pH-ul lor este de 7.
Alte proprietăți
Este un solid higroscopic, adică absoarbe apa din mediu.

Dizolvarea sa în apă face soluția rece, așa că se spune că acest proces de dizolvare este endotermic, cu alte cuvinte, atunci când se dizolvă, absoarbe căldura din mediu și de aceea soluția se răcește.
La temperaturi foarte scăzute azotatul de sodiu este solubil în NH amoniac lichid3, formând NaNO34NH3 sub -42 ºC.
Nano3 Nu este combustibil, dar prezența sa accelerează arderea materialelor sau a compușilor care sunt. Acest lucru se datorează faptului că atunci când este încălzit produce oxigen ODouă, printre alte gaze.
Obținerea
Se obține în principal prin extracție din zăcăminte minerale sau mine de săpăr din Chile (caliche sau nitratit). Pentru aceasta, se utilizează saramură și apoi se efectuează cristalizarea și recristalizarea pentru a obține cristale de NaNO.3 mai pură.
Aceste mine se găsesc în principal în America de Sud, în nordul Chile, în deșertul Atacama. Acolo este asociat cu azotatul de potasiu KNO3 și descompunerea materiei organice.
Poate fi obținut și prin reacția acidului azotic cu carbonat de sodiu NaDouăCO3 sau cu hidroxid de sodiu NaOH:
2 HNO3 + N / ADouăCO3 → 2 NaNO3 + CODouă↑ + HDouăSAU
Prezență în organismul uman
Azotatul de sodiu poate pătrunde în corpul uman prin alimente și apă potabilă care îl conține..
60-80% din nitrații ingerați provin din fructe și legume. O a doua sursă este carnea vindecată. Este folosit de industria cărnii pentru a preveni creșterea microbilor și pentru a păstra culoarea.
Cu toate acestea, o proporție mare de nitrați prezenți în corpul uman provine din sinteza sa endogenă sau din cauza proceselor din corp..
Aplicații
În industria alimentară
Se folosește ca conservant în alimente, ca agent de întărire pentru carnea murată și ca agent de retenție a culorii pentru carne. Alimentele care o pot conține sunt slănină, cârnați, șuncă și câteva brânzeturi.

În îngrășăminte
Azotatul de sodiu este utilizat în amestecurile de îngrășăminte, pentru a fertiliza tutunul, bumbacul și culturile de legume.

Ca promotor sau promotor al arderii sau exploziei
Nano3 este utilizat ca oxidant în multe aplicații. Este un solid bogat în oxigen care facilitează procesul de aprindere prin producerea de ODouă.
Prezența NaNO3 face ca materialele să nu necesite oxigen din surse externe pentru a se aprinde, deoarece furnizează suficient ODouă în ceea ce privește auto-susținerea reacțiilor exotermice (generatoare de căldură) care apar în timpul aprinderii sau exploziei.
A fost folosit de mult timp ca principal oxidant în materialele pirotehnice (artificii), ca component oxidant în explozivi și detonanți sau agenți de sablare și ca agent de propulsie.

Este, de asemenea, utilizat pentru a îmbunătăți arderea cărămizilor de cărbune (brichete), pentru a favoriza iluminarea în chibrituri și chiar pentru a îmbunătăți proprietățile combustibile ale tutunului..
Pentru a elimina rozătoarele și alte mamifere
Este utilizat pentru un tip special de pesticide. Compozițiile care îl conțin sunt fumiganți pirotehnici care sunt plasați și incendiați în vizuini, eliberând doze letale de gaze toxice.
Din acest motiv, este utilizat pentru controlul diferitelor rozătoare, marmote, coioți și sconchi, în câmpuri deschise, pajiști, zone necultivate, peluze și terenuri de golf..
La prepararea altor compuși
Utilizat la fabricarea acidului azotic HNO3, azotit de sodiu NaNODouă, și acționează, de asemenea, ca un catalizator în prepararea acidului sulfuric HDouăSW4.
Este utilizat la fabricarea oxidului de azot NDouăSau și ca agent oxidant în fabricarea compușilor farmaceutici.
În extragerea metalelor din deșeurile electronice
Anumiți cercetători au descoperit că NaNO3 facilitează extracția nepoluantă a metalelor conținute în deșeurile de echipamente electronice (telefoane mobile, tablete, computere etc.).
Metale utile care pot fi extrase din componentele acestor echipamente electronice sunt nichelul Ni, Cobalt Co, Mangan Mn, Zinc Zn, Cupr Cu și Aluminium Al.
Extracția se efectuează folosind doar o soluție de NaNO3 și un polimer. Și se obține un randament de 60%.
În acest fel, deșeurile electronice pot fi reciclate, contribuind la minimizarea deșeurilor și la recuperarea stabilă a resurselor..
În cercetarea sănătății și exercițiilor fizice
Conform unor studii, ingestia de suplimente de NaNO3 sau alimentele care îl conțin în mod natural au efecte pozitive asupra sănătății. Unele dintre alimentele bogate în nitrați sunt sfecla, spanacul și rucola.
Efectele includ îmbunătățirea sistemului cardiovascular, scăderea tensiunii arteriale, îmbunătățirea fluxului sanguin și creșterea cantității de oxigen din țesuturile care exercită fizic..
Acest lucru indică faptul că ar putea fi luată în considerare utilizarea NaNO.3 ca un medicament low cost în prevenirea și tratamentul pacienților cu probleme de tensiune arterială.
În plus, poate servi ca un ajutor natural și eficient pentru creșterea puterii musculare la sportivi.
În diverse utilizări

Este utilizat ca agent de oxidare și flux în fabricarea glazurii de sticlă și ceramică. Se folosește și în cimenturi speciale.
Funcționează ca agent chimic în recuperarea staniului din fier vechi, în coagularea latexului, în industria nucleară și în controlul coroziunii în sistemele apoase.
Riscuri
Pericole de manipulare
Are proprietatea de a accelera arderea materialelor inflamabile. Dacă sunteți implicat într-un incendiu, poate apărea o explozie.
Atunci când este expus la căldură sau foc pentru perioade prelungite, poate exploda, producând oxizi de azot toxici..
Probleme legate de ingestia acestuia cu alimente sau apă
Nitratul, atunci când este ingerat, poate deveni nitrit atât în gură, cât și în stomac și intestine..
Nitritul, atunci când reacționează cu aminele prezente în unele alimente, poate deveni nitrozamine într-un mediu acid, cum ar fi în stomac. Nitrozaminele sunt cancerigene.
Cu toate acestea, acest lucru nu se întâmplă atunci când fructele și legumele care conțin nitrați sunt consumate în mod natural..
Conform unor studii, prezența unor niveluri ridicate de nitrați poate produce o tulburare a sângelui care face ca oxigenul să nu poată fi eliberat eficient în țesuturi.
Acest lucru se poate întâmpla la copiii a căror formulă de lapte este făcută din apă de puț care conține nitrați..
De asemenea, s-a observat că nivelurile ridicate de nitrați pot provoca probleme în gestația copiilor, provocând avorturi spontane, nașteri premature sau defecte în tubul neural al fătului.
Recent s-a constatat că azotatul de sodiu poate prezenta un risc pentru dezvoltarea sistemului musculo-scheletic și comunicarea nervo-musculară este afectată la om.
Azotat de sodiu din alimente

Azotatul de sodiu este sinonim cu carnea, deoarece împreună cu nitritul, li se adaugă pentru a le păstra și a le îmbunătăți aspectul și aromele. Din cauza sa, consumul excesiv de carne (hot dog, slănină, șuncă, pește afumat etc.) a fost implicat în legătura tulburătoare a cancerelor din sistemul digestiv..
Deși relația dintre carnea tratată cu săruri de nitrați-nitriți și cancer nu este absolută, se recomandă moderarea aportului dumneavoastră.
Pe de altă parte, legumele (morcovi, sfeclă, ridichi, salată, spanac etc.) sunt bogate în NaNO3 întrucât l-au absorbit din solurile recoltate datorită acțiunii sale fertilizante. Aportul acestor legume, spre deosebire de produsele din carne, nu este legat de bolile menționate anterior.
Acest lucru se datorează a două motive: diferența dintre nivelurile de proteine ale acestor alimente și modul în care sunt gătite. Când carnea este prăjită sau încălzită la flacără, este promovată reacția dintre nitrați-nitriți cu anumite grupuri de aminoacizi, pentru a produce astfel nitrozoamine: adevărații agenți cancerigeni.
Conținutul de vitamina C, fibre și polifenoli din legume reduce formarea acestor nitrozoamine. De aceea NaNO3 singura nu este o amenințare pentru alimente.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Nitrat de sodiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. și Ravanbod, M. (2015). Studiu cinetic al Mg / NaNO3 pirotehnică folosind tehnica TG / DSC neizotermă. J Therm Anal Calorim (2015) 119: 2281-2288. Recuperat de pe link.springer.com.
- Jarosz, J. și colab. (2016). Azotatul de sodiu scade gruparea receptorilor de acetilcolină indusă de agrin. BMC Pharmacology and Toxicology (2016) 17:20. Recuperat de la bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Prival, M.J. (2003). Cancer. Agenți cancerigeni din lanțul alimentar. În Enciclopedia Științelor Alimentare și Nutriție (Ediția a II-a). Recuperat de la sciencedirect.com.
- Zakhodyaeva, Y.A. și colab. (2019). Extracția complexă a metalelor într-un sistem apos bifazat pe bază de poli (oxid de etilenă) 1500 și nitrat de sodiu. Molecule 2019, 24, 4078. Recuperat de pe mdpi.com.
- Clements, W.T. și colab. (2014). Ingerarea nitraților: o revizuire a efectelor asupra sănătății și performanței fizice. Nutrienți 2014, 6, 5224-5264. Recuperat de la mdpi.com.



Nimeni nu a comentat acest articol încă.