
Conceptul și explicația principiului Aufbau, exemple
Principiul Aufbau Acesta constă dintr-un ghid util pentru a prezice teoretic configurația electronică a unui element. Cuvantul aufbau se referă la verbul german „a construi”. Regulile dictate de acest principiu sunt menite să „ajute la construirea atomului”.
Când vorbim despre construcția atomică ipotetică, aceasta se referă exclusiv la electroni, care la rândul lor merg mână în mână cu numărul tot mai mare de protoni. Protonii definesc numărul atomic Z al unui element chimic și, pentru fiecare adăugat la nucleu, se adaugă un electron pentru a compensa această creștere a sarcinii pozitive..
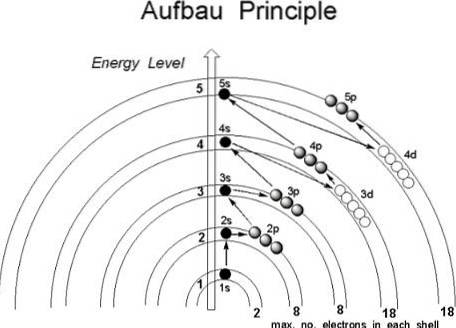
Deși se pare că protonii nu urmează o ordine stabilită pentru a se alătura nucleului atomului, electronii respectă o serie de condiții, în așa fel încât să ocupe mai întâi regiunile atomului cu energie mai mică, în special cele în care probabilitatea de a le găsi în spațiu este mai mare: orbitalii.
Principiul Aufbau, împreună cu alte reguli de umplere electronice (principiul excluderii Pauli și regula lui Hund), ajută la stabilirea ordinii în care ar trebui adăugați electronii în norul de electroni; în acest fel, este posibilă atribuirea unei configurații electronice corespunzătoare a unui anumit element chimic.
Indice articol
- 1 Concept și explicație
- 1.1 Straturi și substraturi
- 1.2 Principiul de excludere al lui Pauli și regula lui Hund
- 2 Exemple
- 2.1 Carbon
- 2.2 Oxigen
- 2.3 Calciul
- 3 Limitări ale principiului Aufbau
- 4 Referințe
Concept și explicație
Dacă atomul ar fi considerat ca și cum ar fi o ceapă, un număr finit de straturi ar fi găsit în interiorul acestuia, determinat de numărul cuantic principal n.
Mai mult, în interiorul lor, sunt sub-cochilii, ale căror forme depind de numerele cuantice l azimutal și magnetic m.
Orbitalii sunt identificați prin primele trei numere cuantice, în timp ce al patrulea, spinul s, ajunge să indice în ce orbital va fi localizat electronul. Apoi, în aceste regiuni ale atomului, unde electronii se rotesc, de la cel mai interior la cel mai exterior: stratul de valență, cel mai energic dintre toate..
Acesta fiind cazul, în ce ordine ar trebui electronii să umple orbitalii? Conform principiului Aufbau, acestea ar trebui atribuite pe baza valorii crescânde (n + l).
La fel, în interiorul sub-coajelor (n + l) electronii trebuie să ocupe sub-coaja cu cea mai mică valoare energetică; cu alte cuvinte, acestea ocupă cea mai mică valoare a lui n.
Urmând aceste reguli de construcție, Madelung a dezvoltat o metodă vizuală care constă în desenarea săgeților diagonale, care ajută la construirea configurației electronice a unui atom. În unele sfere educaționale, această metodă este cunoscută și sub numele de metoda ploii..
Straturi și substraturi
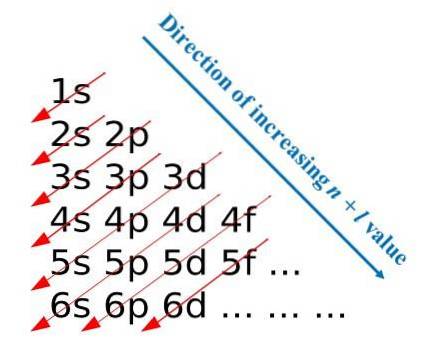
Prima imagine ilustrează o metodă grafică pentru obținerea configurațiilor electronice, în timp ce a doua imagine este metoda Madelung respectivă. Cele mai energice straturi sunt situate în partea de sus și cele mai puțin energetice sunt în direcție descendentă..
De la stânga la dreapta, substraturile s, p, d și f ale nivelurilor lor principale de energie corespunzătoare sunt „tranzitate”. Cum se calculează valoarea (n + l) pentru fiecare pas marcat de săgețile diagonale? De exemplu, pentru orbitalul 1s acest calcul este egal cu (1 + 0 = 1), pentru orbitalul 2s (2 + 0 = 2) și pentru orbitalul 3p (3 + 1 = 4).
Rezultatul acestor calcule are originea în construcția imaginii. Prin urmare, dacă nu este disponibil la îndemână, pur și simplu determinați (n + l) pentru fiecare orbital, începând să umpleți orbitalii cu electroni de la cel cu cea mai mică valoare de (n + l) până la cel cu valoarea maximă.
Cu toate acestea, utilizarea metodei Madelung facilitează foarte mult construcția configurației electronice și o face o activitate distractivă pentru cei care învață tabelul periodic..
Principiul de excludere al lui Pauli și regula lui Hund
Metoda Madelung nu indică orbitalele sub-coajelor. Luându-le în considerare, principiul excluderii Pauli afirmă că niciun electron nu poate avea aceleași numere cuantice ca altul; sau ceea ce este la fel, o pereche de electroni nu poate avea atât rotiri pozitive, cât și negative.
Aceasta înseamnă că numerele lor cuantice de rotire s nu pot fi egale și, prin urmare, rotirile lor trebuie să se împerecheze atunci când ocupă același orbital.
Pe de altă parte, umplerea orbitalilor trebuie făcută în așa fel încât să fie degenerate în energie (regula lui Hund). Acest lucru se realizează păstrând toți electronii din orbitali nepereche, până când este strict necesar să împerechem o pereche din aceștia (ca și oxigenul).
Exemple
Următoarele exemple rezumă întregul concept al principiului Aufbau..
Carbon
Pentru a determina configurația sa electronică, trebuie să se cunoască mai întâi numărul atomic Z și, astfel, numărul de electroni. Carbonul are Z = 6, deci cei 6 electroni ai săi trebuie să fie localizați pe orbitali folosind metoda Madelung:

Săgețile corespund electronilor. După umplerea orbitalilor 1s și 2s, fiecare cu doi electroni, orbitalilor 2p prin diferență li se atribuie restul de doi electroni. Regula lui Hund se manifestă astfel: doi orbitali degenerați și unul gol.
Oxigen

Oxigenul are Z = 8, deci are doi electroni suplimentari spre deosebire de carbon. Unul dintre acești electroni trebuie plasat în orbitalul 2p gol, iar celălalt trebuie să se împerecheze pentru a forma prima pereche, cu săgeata îndreptată în jos. În consecință, aici se manifestă principiul excluderii Pauli.
Calciu
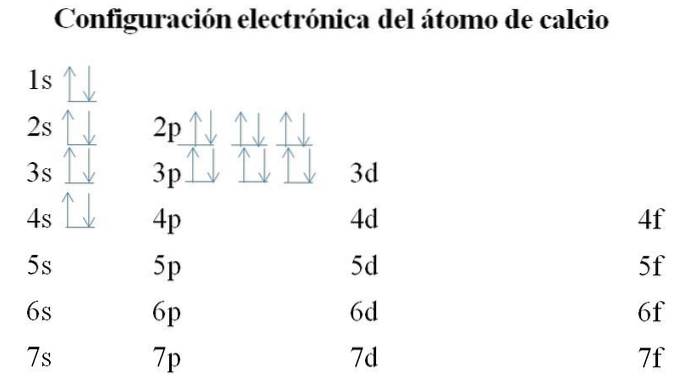
Calciul are 20 de electroni, iar orbitalii sunt încă umpluți cu aceeași metodă. Ordinea de umplere este următoarea: 1s-2s-2p-3s-3p-4s.
Se poate observa că, în loc să umple mai întâi orbitalul 3d, electronii ocupă 4s. Acest lucru se întâmplă înainte de a face loc metalelor de tranziție, elemente care umplu stratul interior 3d.
Limitările principiului Aufbau
Principiul lui Aufbau nu reușește să prezică configurațiile electronice ale multor metale de tranziție și elemente ale pământului rar (lantanide și actinide).
Acest lucru se datorează faptului că diferențele energetice dintre orbitalele ns și (n-1) d sunt scăzute. Din motive susținute de mecanica cuantică, electronii pot prefera să degenereze orbitalele (n-1) d cu prețul de a anula sau a disloca electronii din orbitalul ns.
Un exemplu celebru este cazul cuprului. Configurația sa electronică prezisă de principiul Aufbau este 1sDouă2sDouă2 P63sDouă3p64sDouă3d9, când experimental s-a dovedit a fi 1sDouă2sDouă2 P63sDouă3p64s13d10.
În primul, un electron solitar este despărțit într-un orbital 3d, în timp ce în al doilea, toți electronii din orbitalii 3d sunt împerecheați..
Referințe
- Helmenstine, Anne Marie, dr. (15 iunie 2017). Definiția principiului Aufbau. Luat de pe: thoughtco.com
- Prof. N. De Leon. (2001). Principiul Aufbau. Luat de la: iun.edu
- Chimie 301. Principiul Aufbau. Luat din: ch301.cm.utexas.edu
- Hozefa Arsiwala și teacherlookup.com. (1 iunie 2017). În profunzime: Principiul Aufbau cu exemple. Preluat de pe: teacherlookup.com
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 199-203.
- Goodphy. (27 iulie 2016). Schema lui Madelung. [Figura]. Luat de pe: commons.wikimedia.org


Nimeni nu a comentat acest articol încă.