
Prioni caracteristici, structură, funcții, boli
prioni sunt proteine fără genom sau acizi nucleici care acționează ca agenți infecțioși. Termenul „prion” înseamnă particule infecțioase proteice (din engleză Proteinaceous Infectious Particles) și a fost inventat de neurologul și laureatul Premiului Nobel, Stanley B. Prusiner.
În 1982, Prusiner și colegii săi au identificat o particulă de proteină infecțioasă, în timp ce studiau cauzele bolilor Creutzfeldt-Jakob (la om) și ale encefalopatiei spongiforme bovine..
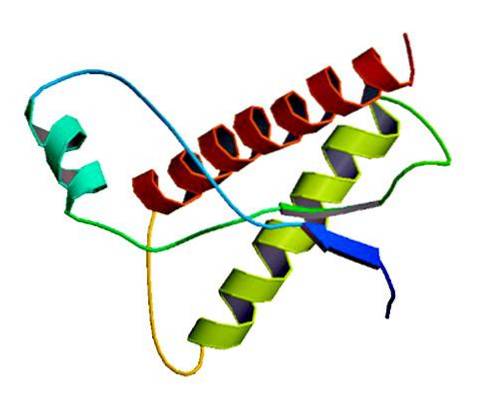
Acești agenți infecțioși rari se găsesc în membrana celulelor normale, doar ca proteine pliate greșit și / sau cu o structură tridimensională anormală. Aceste proteine sunt responsabile de boli degenerative multiple și de mortalitate foarte mare care afectează țesuturile neuronale și structura creierului..
Sunt numite și boli prionice. Printre cele mai importante care afectează oamenii sunt kuru, boala Gerstmann-Sträussler-Scheinker, sindromul Creutzfeldt-Jakob și insomnia familială fatală..
Indice articol
- 1 Caracteristici generale
- 2 Structuri
- 2.1 PrP (C)
- 2.2 PrP (Sc)
- 3 Funcții
- 3.1 Cu receptori metabotropi de glutamat
- 3.2 În dezvoltarea embrionară
- 3.3 Neuroprotector
- 3.4 Sistemul nervos periferic
- 3.5 Moartea celulelor
- 3.6 Memorie pe termen lung
- 3.7 Reînnoirea celulelor stem
- 4 Boli cauzate de prioni
- 4.1 Boala Creutzfeldt-Jakob (CJD)
- 4.2 Boala Gerstmann-Sträussler-Scheinker
- 4.3 Prionopatie cu sensibilitate variabilă la protează
- 4.4 Insomnie letală
- 4.5 Kuru
- 4.6 Boli la animale
- 5 tratamente
- 6 Prevenirea
- 7 Referințe
Caracteristici generale
Prionii sunt structuri proteice prezente în membranele celulare. Aceste proteine au o formă sau o conformație modificate [PrP (Sc)].
În ceea ce privește multiplicarea sa, se realizează prin conversia formelor, ca în cazul bolii scrapie. În această boală, prionii recrutează PrP (C) (proteine prionice de conformație nealterată) pentru a stimula conversia în izoforma PrP (Sc)..
Acest lucru generează o reacție în lanț care răspândește materialul infecțios și, prin urmare, permite irigarea bolii. Încă nu se știe cum are loc acest proces de conversie.
Aceste proteine neobișnuite capabile de propagare, nu au acizi nucleici. Dovadă este faptul că sunt rezistente la razele X și radiațiile ultraviolete. Acești agenți descompun cu ușurință acizii nucleici.
Proteinele prionice, din care sunt compuși prionii (PrP), se găsesc în tot corpul, nu numai la om, ci și la alte vertebrate sănătoase. Aceste proteine sunt în general rezistente la proteaze (enzime care catalizează proteinele).
Se știe foarte puțin despre utilitatea proteinelor prionice PrP (C), forma normală a proteinei neinfecțioase din corpul uman..
Cu toate acestea, unii cercetători au reușit să demonstreze că, la șoareci, aceste proteine activează repararea mielinei în celulele sistemului nervos periferic. S-a dovedit că absența acestora provoacă demielinizarea unor astfel de celule nervoase..
Structuri
Cunoștințele despre structura prionilor rezidă în principal în investigațiile efectuate în bacterie Escherichia coli.
Studiile au arătat că polipeptidele în lanț PrP (C) (normale) și PrP (Sc) (infecțioase) sunt identice în compoziția aminoacizilor, dar diferă prin conformarea 3D și prin pliere..
PrP (C)
Acești prioni neinfecțioși au la om 209 de aminoacizi. Au o legătură disulfură. Structura sa este alfa-elicoidală, ceea ce înseamnă că are aminoacizi în formă de spirală (helice alfa) și câteva fire plate de aminoacizi (foi beta)..
Această proteină nu poate fi separată prin centrifugare, ceea ce implică faptul că nu este sedimentabilă. Este ușor de digerat de serina protează cu spectru larg numită proteinază K.
PrP (Sc)
Este o proteină infecțioasă care transformă PrP (C) în izoforme infecțioase PrP (Sc) și cu o configurație sau formă anormală.
Se știe foarte puțin despre structura sa 3D, totuși se știe că are puține forme elicoidale și mai multe fire plate sau foi beta. Trecerea la izoformă este ceea ce este cunoscut sub numele de eveniment pivot al bolilor prionice.
Caracteristici
Proteinele prionice celulare [Prp (C)] sunt localizate pe suprafața celulară a unei largi varietăți de organe și țesuturi. Se știe foarte puțin despre funcțiile fiziologice ale prionilor din corp. Chiar și așa, experimentele făcute la șoareci indică posibile funcții, cum ar fi:
Cu receptori de glutamat metabotrop
S-a demonstrat că PrP (C) acționează cu receptorii glutamatului (ionotrop și metabotrop). PrP (C) participă ca receptor pentru oligomerii sinaptotoxici ai peptidei Aβ de pe suprafața celulei.
În dezvoltarea embrionară
La șoarecii din familia Murinae, s-a descoperit că proteinele prionice PrP (C) sunt exprimate în câteva zile după implantare, în dezvoltarea embrionară.
Acest lucru indică faptul că acestea joacă un rol în timpul dezvoltării acestor mici mamifere. Rolul care, potrivit cercetătorilor, este legat de reglarea neuritogenezei (producerea axonilor și a dendritelor neuronilor).
Aceștia acționează și asupra creșterii axonale. Aceste proteine prionice sunt chiar implicate în dezvoltarea circuitului cerebelos. Datorită acestui fapt, se crede că absența acestor prioni PrP (C) atrage după sine o întârziere în dezvoltarea motorie a rozătoarelor..
Neuroprotector
În studiile privind supraexprimarea PrP (C) prin orientarea genică, s-a constatat că absența acestor prioni provoacă probleme cu alimentarea cu sânge a unor părți ale creierului (ischemie cerebrală acută).
Aceasta înseamnă că proteinele prionice funcționează ca neuroprotectori. În plus, s-a demonstrat că supraexpresia PrP (C) poate reduce sau îmbunătăți leziunile cauzate de ischemie..
Sistem nervos periferic
Rolul fiziologic al Prp (C) în menținerea mielinei periferice a fost descoperit recent.
În timpul unui studiu de laborator s-a descoperit că, în absența proteinei prionice, șoarecii de laborator au dezvoltat deficiențe ale nervilor care transportă informații din creier și măduva spinării, în ceea ce se numește neuropatie periferică..
Moartea celulelor
Există unele proteine care sunt similare cu prionii, iar acestea sunt localizate în alte părți ale corpului decât creierul.
Funcțiile acestor proteine sunt de a iniția, regla și / sau controla moartea celulară, atunci când organismul este atacat (de exemplu, de vironi), prevenind astfel răspândirea agentului patogen..
Această funcție particulară a acestor proteine îi face pe cercetători să se gândească la importanța posibilă a prionilor neinfecțioși în lupta împotriva agenților patogeni..
Memorie pe termen lung
Un studiu realizat la Institutul Stowers, din Missouri, SUA, a arătat că prionii PrP pot avea un rol în menținerea memoriei pe termen lung.
Studiul a arătat că anumite proteine prionice pot fi controlate pentru a acționa în menținerea funcțiilor fiziologice ale memoriei pe termen lung..
Reînnoirea celulelor stem
O investigație asupra proteinelor prionice care sunt exprimate în celulele stem ale țesutului sanguin a arătat că toate aceste celule stem (hematopoietice) exprimă proteinele prionice în membrana lor celulară. Pentru ceea ce se crede că participă la procesul complex și foarte important de reînnoire celulară.
Bolile prionice
Patologiile de origine prionică sunt recunoscute ca tulburări degenerative progresive ale creierului. Pot ataca bovine, căprioare, caribou, oi și chiar oameni.
Aceste boli sunt cauzate de o modificare a structurii proteinelor PrP (C) și ale cărei funcții specifice sunt încă incerte în prezent. Patologiile prionice pot apărea fără o cauză cunoscută. Ele pot avea o origine genetică moștenită și pot fi transmise, de asemenea, într-un mod infecțio-contagios.
Prionii provoacă boli familiale, sporadice și contagioase. Bolile prionice familiale sunt cele care sunt ereditare. Patologiile sporadice sunt cele mai frecvente și apar fără cauze cunoscute..
Bolile contagioase sunt considerate rare, sunt transmise de la persoană la persoană, de la animal la animal, de la persoană la animal și invers. Cauzele sunt multiple și variază de la consumul de carne contaminată, canibalism, transfuzii, până la manipularea echipamentelor chirurgicale contaminate.
Cele mai frecvente boli prionice sunt:
Boala Creutzfeldt-Jakob (CJD)
Considerată cea mai frecventă boală prionică în rândul ființelor umane, este o boală cosmopolită, adică are o distribuție la nivel mondial. Poate fi ereditar (familial), sporadic sau infecțios.
Pacienții prezintă simptome precum demență, scuturări sau mișcări bruște involuntare și deficiențe ale sistemului nervos central.
În funcție de tratamentul și forma bolii, moartea poate apărea între 4 luni și 2 ani de la dobândirea bolii. Diagnosticul este dificil de realizat, de obicei se face post morten, în timpul autopsiei.
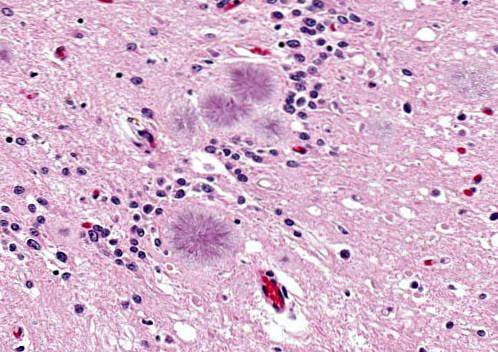
Boala Gerstmann-Sträussler-Scheinker
Este o boală cauzată de prioni într-un proces moștenitor sau autosomal dominant al creierului infecțios. Boala se manifestă la persoanele cu vârsta cuprinsă între 40 și 60 de ani.
Acești oameni manifestă probleme de articulare a cuvintelor (disartrie), scuturări sau mișcări bruște involuntare, agresivitatea fiind frecventă.
Se prezintă cu degenerescență cerebeloasă însoțită de un mers nesigur. De asemenea, este posibil să se observe hiporeflexie, surditate, paralizie a privirii, demență, printre alte simptome. Speranța de viață este de aproximativ 5 ani sau puțin mai mult.
Prionopatie cu sensibilitate variabilă la protează
Este o boală foarte rară, până la punctul în care intervalul său de apariție este de 2 până la 3 cazuri la 100 de milioane de locuitori. Patologia este similară cu boala Gerstmann-Sträussler-Scheinker.
Manifestările clinice ale proteinei indică o rezistență scăzută la proteaze, unele sunt mai multe și altele mai puțin sensibile la aceste enzime.
Simptomele pe care le prezintă pacienții sunt: probleme cu vorbirea și tulburările cognitive, pierderea neuronilor din zona în care creierul controlează mișcările și efectuează coordonarea musculară.
Boala este frecventă la pacienții vârstnici (70 de ani), iar durata de viață estimată după infectare este de aproximativ 20 de luni.
Insomnie fatală
Este o boală ereditară sau familială, poate apărea și sporadic. Se știe că boala se datorează unei mutații dominante ereditare sau autozomale.
Pacienții prezintă simptome cum ar fi probleme cumulative de somn și menținerea somnului, demență, tulburări cognitive, chiar probleme de hipertensiune, tahicardie, hiperhidroză și altele..
Vârsta pe care o afectează este destul de largă, variind între 23 și 73 de ani, totuși vârsta medie este de 40 de ani. Durata de viață odată infectată este de puțin peste 6 ani.
Kuru
Această boală prionică a fost detectată doar la locuitorii din Papua Noua Guinee. Este o boală legată de canibalism și de tradiția culturală a ritului de doliu al morților, unde acești oameni mănâncă carne de creier sau de om.
Persoanele care poartă boala au de obicei mișcări incontrolabile și involuntare în diferite părți ale corpului.
Prezintă tremurături, pierderea controlului mișcărilor și pierderea coordonării musculare. Speranța de viață la persoanele infectate este de doi ani.
Boli la animale
Printre patologiile produse de prioni la animale se numără encefalopatia spongiformă bovină. Această boală a provocat ravagii în Europa, în sănătatea publică, în cea a animalelor și în economia țărilor afectate.
Alte boli la animale includ scrapie, encefalopatie de nurcă transmisibilă, boală cronică de pierdere (la căprioare) și encefalopatie spongiformă felină..
Aceste boli, la fel ca cele prezentate la om, nu au un tratament eficient, deci prevenirea este esențială, mai ales după infecții la om care au apărut ca urmare a consumului de carne de la vacile infectate..
Tratamente
Până în prezent, nu există un tratament cunoscut pentru bolile prionice. Tratamentul este simptomatic. Pacienții sunt sfătuiți să planifice îngrijiri paliative și se recomandă testarea genetică și consilierea membrilor familiei.
O mare varietate de medicamente au fost testate la pacienții cu boli prionice, cum ar fi antivirale, antitumorale, medicamente pentru boli precum Parkinson, tratamente pentru imunosupresie, antibiotice, antifungice, chiar și antidepresive..
Cu toate acestea, în prezent nu există dovezi care să indice că unele dintre acestea reduc simptomele sau îmbunătățesc supraviețuirea pacienților..
Prevenirea
Prionii sunt rezistenți la o varietate de modificări fizice și chimice. Cu toate acestea, se utilizează diferite tehnici pentru a evita contaminarea pacienților cu instrumente chirurgicale contaminate..
Printre cele mai utilizate tehnici se numără sterilizarea echipamentului într-o autoclavă la 132 ° C timp de o oră și apoi scufundarea instrumentelor în hidroxid de sodiu cel puțin încă o oră..
Pe de altă parte, organizația mondială a sănătății (OMS) a dezvoltat măsuri pentru prevenirea răspândirii bolilor prionice. Această organizație stabilește norme pentru manipularea țesuturilor interzise sau potențial riscante, cum ar fi: ochii, creierul, intestinul, amigdalele și măduva spinării.
Referințe
- Prion, agent infecțios. Recuperat de la britannica.com.
- Ce este un prion? Recuperat de la scientificamerican.com.
- P.C. Kalikiri, R.G. Sachan. 2003. Prioni - Particule infecțioase proteice. Jurnal, Academia Indiană de Medicină Clinică.
- Prion. Recuperat de pe en.wikipedia.org
- K.M. Pan, M. Baldwin, J. Nguyen, M. Gasset, A. Serban, D. Groth, I. Mehlhorn, Z. Huang, R.J. Fletterick, F.E. Cohen (1993). Conversia elicoidelor alfa în foi beta prezintă caracteristici în formarea proteinelor prion scrapie. Lucrările Academiei Naționale de Științe din Statele Unite ale Americii.
- M.-A. Wulf, A. Senatore și A. Aguzzic (2017). Funcția biologică a proteinei prionice celulare: o actualizare. BCM Biology.
- DC Zhang, A.D. Steele, S. Lindquist, H.F. Lodish (2006). Proteina prionică este exprimată pe celule stem hematopoietice de repopulare pe termen lung și este importantă pentru autoînnoirea lor. Lucrările Academiei Naționale de Științe din Statele Unite ale Americii.
- Revizuirea bolilor prionice (encefalopatii spongiforme transmisibile) Adus de pe msdmanuals.com.
- E. Arranz-Martínez, G. Trillo-Sánchez-Redondo, A. Ruiz-García, S. Ares-Blanco (2010). Prionpatii: encefalopatii prionice. Medicina de familie. SEMERGEN.


Nimeni nu a comentat acest articol încă.