
Care este punctul de echivalență și la ce servește?
punct de echivalare Este una în care două substanțe chimice au reacționat complet. În reacțiile acid-bazice, acest punct indică momentul în care un întreg acid sau bază a fost neutralizat. Acest concept este pâinea zilnică a titrărilor sau evaluărilor volumetrice și este determinată prin intermediul unor calcule matematice simple.
Dar care este gradul? Este un proces în care un volum al unei soluții de concentrație cunoscută, numit titrant, este adăugat cu atenție la o soluție de concentrație necunoscută, pentru a obține concentrația sa.

Utilizarea unui indicator de pH permite cunoașterea momentului în care se termină titrarea. Indicatorul este adăugat la soluția care este titrată pentru a face cuantificarea concentrației pe care se dorește să o cunoască. Un indicator acid-bazic este un compus chimic a cărui culoare depinde de concentrația de hidrogen sau pH-ul mediului..
Cu toate acestea, schimbarea culorii indicatorului indică punctul final al titrării, dar nu punctul de echivalență. În mod ideal, ambele puncte ar trebui să coincidă; dar în realitate, schimbarea culorii poate apărea în câteva picături după ce neutralizarea acidului sau bazei a fost finalizată..
Indice articol
- 1 Care este punctul de echivalență?
- 1.1 Punct final
- 2 Punctul de echivalență al titrării unui acid puternic cu o bază puternică
- 3 Curba slabă de titrare a bazelor puternic acid
- 3.1 Etape
- 3.2 Selectarea indicatorului în funcție de punctul de echivalență
- 4 Referințe
Care este punctul de echivalență?
O soluție de acid de concentrație necunoscută plasată într-un balon poate fi titrată prin adăugarea lentă a unei soluții de hidroxid de sodiu de concentrație cunoscută folosind o buretă..
Selectarea unui indicator trebuie făcută în așa fel încât să-și schimbe culoarea în momentul în care au reacționat aceeași cantitate de echivalenți chimici ai soluției de titrant și a soluției cu concentrație necunoscută..
Acesta este punctul de echivalență, în timp ce punctul în care un indicator își schimbă culoarea se numește punctul final, unde se termină titrarea..
Punct final
Ionizarea sau disocierea indicatorului este reprezentată după cum urmează:
HIn + HDouăSAU <=> În- + H3SAU+
Prin urmare, are o Ka constantă
Ka = [H3SAU+] [În-] / [HIn]
Relația dintre indicatorul nedisociat (HIn) și indicatorul disociat (In-) determină culoarea indicatorului.
Adăugarea unui acid crește concentrația de HIn și produce culoarea indicatorului 1. Între timp, adăugarea unei baze favorizează o creștere a concentrației indicatorului disociat (In-) (culoarea 2).
Este de dorit ca punctul de echivalență să se potrivească cu punctul final. Pentru a face acest lucru, este selectat un indicator cu un interval de schimbare a culorii care include punctul de echivalență. În plus, încearcă să reducă orice erori care produc o diferență între punctul de echivalență și punctul final.
Standardizarea sau titrarea unei soluții este un proces în care se determină concentrația exactă a unei soluții. Este metodologic un grad, dar strategia urmată este diferită.
O soluție a standardului primar este plasată în balon și soluția de titrant care este standardizată este adăugată cu un buret..
Punctul de echivalență al titrării unui acid puternic cu o bază puternică
100 ml de HCI 0,1 M se plasează în balon și se adaugă treptat o soluție de NaOH 0,1 M printr-o buretă, determinând modificările de pH ale soluției care originează acidul clorhidric.
Inițial înainte de a adăuga NaOH, pH-ul soluției de HCI este 1.
Se adaugă baza puternică (NaOH) și pH-ul crește treptat, dar este încă un pH acid, deoarece excesul de acid determină acest pH.
Dacă continuați să adăugați NaOH, vine un moment în care se atinge punctul de echivalență, în care pH-ul este neutru (pH = 7). Acidul a reacționat cu baza consumată, dar nu există încă un exces de bază.
Concentrația de clorură de sodiu, care este o sare neutră (nici Na+ nici Cl- hidroliza).
Dacă continuați să adăugați NaOH, pH-ul continuă să crească, devenind mai bazic decât punctul de echivalență, deoarece predomină concentrația de NaOH..
În mod ideal, schimbarea culorii indicatorului ar trebui să aibă loc la pH = 7; dar datorită formei ascuțite a curbei de titrare, poate fi utilizată fenolftaleina care se transformă într-o culoare roz pal la un pH de aproximativ 8.
Curba slabă de titrare a bazelor puternic acid
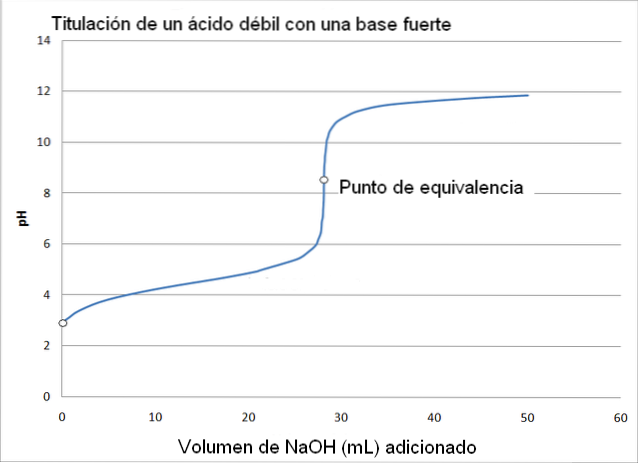
În acest caz, un acid slab, cum ar fi acidul acetic (CH3COOH) cu o bază puternică, hidroxid de sodiu (NaOH). Reacția care apare în titrare poate fi conturată după cum urmează:
NaOH + CH3COOH => CH3GÂNGURI-N / A+ + HDouăSAU
În acest caz, tamponul acetat este format cu un pKa = 4,74. Regiunea tamponată poate fi văzută în modificarea ușoară și aproape imperceptibilă înainte de pH 6.
Punctul de echivalență, așa cum indică imaginea, este în jur de 8,72 și nu 7 De ce? Deoarece CH3GÂNGURI- este un anion care după hidrolizare generează OH-, care bazifică pH-ul:
CH3GÂNGURI- + HDouăSAU <=> CH3COOH + OH-
Etape
Titrarea acidului acetic prin hidroxid de sodiu poate fi împărțită în 4 etape pentru analiză.
-Înainte de a începe să adăugați baza (NaOH), pH-ul soluției este acid și depinde de disocierea acidului acetic.
-Pe măsură ce se adaugă hidroxid de sodiu, se formează soluția tampon acetat, dar în același mod crește formarea bazei conjugate acetat, ceea ce aduce cu sine o creștere a pH-ului soluției..
-Punctul de echivalență pH apare la un pH de 8,72, care este sincer alcalin..
Punctul de echivalență nu are o valoare constantă și variază în funcție de compușii implicați în titrare..
-Pe măsură ce adăugați în continuare NaOH, după atingerea punctului de echivalență, pH-ul crește datorită unui exces de hidroxid de sodiu.
Selectarea indicatorului în funcție de punctul de echivalență
Fenolftaleina este utilă în determinarea punctului de echivalență în această titrare, deoarece are punctul de cotitură al culorii la un pH de aproximativ 8, care se încadrează în zona de pH a titrării acidului acetic care include echivalența punctului (pH = 8,72).
Pe de altă parte, roșul de metil nu este util în determinarea punctului de echivalență, deoarece își schimbă culoarea în intervalul de pH de la 4,5 la 6,4.
Referințe
- Wikipedia. (2018). Punct de echivalare. Recuperat de pe: es.wikipedia.org
- Helmenstine, Anne Marie, dr. (22 iunie 2018). Definiția punctului de echivalență. Recuperat de pe: thoughtco.com
- Lusi Madisha. (16 aprilie 2018). Diferența dintre punctul final și punctul de echivalență. " DifferenceBetween.net. Recuperat de la: differencebetween.net
- Uite J. (2018). Punct de echivalență: definiție și calcul. Recuperat de la: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. & Stanley, G. G. Chemistry. (2008) Ediția a opta. Editorii de învățare Cengage.



Nimeni nu a comentat acest articol încă.