
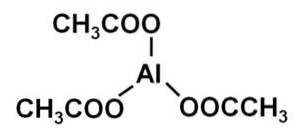
Structura acetat de aluminiu (Al (CH3COO) 3), proprietăți, utilizări

acetat de aluminiu este un compus organic format dintr-un ion de aluminiu Al3+ și trei ioni acetat CH3GÂNGURI-. Formula sa chimică este Al (CH3GÂNGURI)3. Este, de asemenea, cunoscut sub numele de triacetat de aluminiu. Este un solid alb ușor higroscopic și solubil în apă..
Pentru a obține acest compus, trebuie utilizate condiții total anhidre, adică fără apă, altfel diacetat de aluminiu Al (OH) (CH3GÂNGURI)Două.
Soluțiile de acetat de aluminiu au proprietăți antibacteriene și antifungice, motiv pentru care încă din secolul al XIX-lea au fost utilizate pentru tratarea infecțiilor în special ale urechilor..
Cea mai cunoscută este soluția lui Burow, concepută de un medic german. Cu toate acestea, utilizarea sa a dus ocazional la deteriorarea urechii medii..
Această soluție a fost, de asemenea, utilizată pentru tratarea problemelor pielii, cum ar fi mâncărimea și erupțiile cutanate. Este chiar folosit ca un antialgic.
Acetat de aluminiu și derivații săi sunt utilizați pentru a obține structuri sau particule foarte mici de alumină AlDouăSAU3. Aceste structuri sau nanoparticule pot fi sub formă de frunze, flori sau nanotuburi..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Solubilitate
- 3.4 Proprietăți chimice
- 3.5 Alte proprietăți
- 4 Obținerea
- 5 Utilizări în medicină
- 5.1 Infecții ale urechii
- 5.2 Boli de piele
- 6 Alte utilizări
- 6.1 Utilizarea întreruptă
- 7 Efecte nocive
- 8 Referințe
Structura
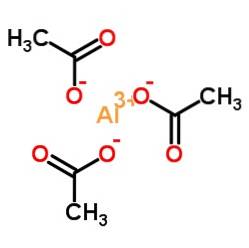
Triacetatul de aluminiu este alcătuit dintr-un cation de aluminiu Al3+ și trei anioni acetat CH3GÂNGURI-. Este sarea de aluminiu a acidului acetic CH3COOH.
Aluminiu este legat de acetat de anioni prin oxigenul lor. Cu alte cuvinte, este atașat la trei oxigeni. Aceste joncțiuni sunt ionice.
Nomenclatură
- Acetat de aluminiu
- Triacetat de aluminiu
- Etanoat de aluminiu
- Soluția Burow (traducere din engleză Soluția lui Burow): Este o soluție de acetat de aluminiu.
Proprietăți
Starea fizică
Alb solid.
Greutate moleculară
204,11 g / mol
Solubilitate
Solubil în apă.
Proprietăți chimice
În soluție apoasă, triacetatul de aluminiu este dizolvat și tinde să formeze diacetat de Al (OH) (CH3COO) și uneori monoacetat de Al (OH)Două(CH3GÂNGURI). Totul depinde de pH-ul și cantitatea de acid acetic CH3COOH prezent în soluție.
Al (CH3GÂNGURI)3 + HDouăO ⇔ Al (OH) (CH3GÂNGURI)Două + CH3COOH
Al (CH3GÂNGURI)3 + 2 oreDouăO ⇔ Al (OH)Două(CH3COO) + 2 CH3COOH
Alte proprietăți
Acetatul de aluminiu este ușor higroscopic, adică tinde să absoarbă apa din aer.
Obținerea
Acetat de aluminiu se obține de preferință în condiții strict anhidre, adică în absența totală a apei. Aceasta include și absența aerului, deoarece poate conține umiditate..
Se încălzește un amestec de acid acetic glacial CH3COOH și anhidridă acetică (CH3CO)DouăSau în condiții astfel încât toată apa prezentă să poată fi eliminată. La acest amestec fierbinte se adaugă clorură de aluminiu AlCI.3 solid anhidru (fără apă).
Un solid alb de Al (CH3GÂNGURI)3.
AlCl3 + 3 CH3COOH → Al (CH3GÂNGURI)3 + 3 HCI
Absența totală a apei este importantă pentru a evita formarea sărurilor de monoacetat de aluminiu Al (OH)Două(CH3COO) și diacetat de aluminiu Al (OH) (CH3GÂNGURI)Două.
Poate fi obținut și prin reacția hidroxidului de aluminiu Al (OH)3 și acid acetic CH3COOH.
Utilizări în medicină
Infecții ale urechii
Acetat de aluminiu a fost utilizat încă din secolul al XIX-lea pentru tratarea otitei, care este o inflamație a urechii externe sau medii însoțită de obicei de infecție. Utilizarea sa se datorează efectului său antibacterian și antifungic.
A fost utilizat sub forma unei soluții de acetat de aluminiu de 13%, concepută inițial de medicul german Karl August von Burow, motiv pentru care se numește soluția Burow..
S-a constatat că inhibă creșterea microorganismelor întâlnite în mod obișnuit în otita medie sau externă, cum ar fi otita medie. Pseudomonas aeruginosa, Staphylococcus aureus si Proteus mirabilis.

Cu toate acestea, există cei care raportează că aceste soluții pot fi dăunătoare urechii. Unele studii pe animale investighează efectele sale toxice asupra urechii, dar au raportat rezultate contradictorii..
Anumiți cercetători recomandă să nu utilizați acetat de aluminiu atunci când membrana timpanică este perforată, deoarece s-a observat că exercită un efect inflamator asupra urechii medii.
Boli de piele
Soluția Burow este utilizată ca antiseptic, astringent și ca soluție topică pentru tratarea erupțiilor cutanate severe, dermatite, inflamații, mâncărimi, arsuri și arsuri solare. Are un efect calmant și de reducere a iritației.
Alte utilizări
Triacetatul de aluminiu și derivații săi sunt utilizați pentru multe experimente chimice calitative și cantitative.
Un derivat al triacetatului de aluminiu, Al (OH) (CH3GÂNGURI)Două numit și acetat de hidroxid de aluminiu, este folosit ca precursor pentru obținerea nanostructurilor de gamma-alumină (γ-AlDouăSAU3).
În acest caz, precursorul înseamnă că nanostructurile γ-Al sunt preparate din diacetat de aluminiu (obținut într-un mod particular).DouăSAU3, iar acest lucru se realizează încălzindu-l la temperaturi foarte ridicate.
Nanostructurile sunt particule foarte mici, care pot fi observate numai prin intermediul unor microscoape speciale, cum ar fi microscopurile electronice. Cu acetat de aluminiu ca precursor, s-au obținut nanostructuri γ-AlDouăSAU3 asemănător cu frunzele, florile, fibrele și chiar nanotuburile.

Utilizare întreruptă
La începutul secolului al XX-lea, acetat de aluminiu a fost folosit ca conservant în alimente, cum ar fi conserve de cârnați.
O soluție de acetat de aluminiu a fost preparată prin amestecarea sulfatului de aluminiu AlDouă(SW4)3, carbonat de calciu CaCO3, acid acetic CH3COOH și apă HDouăSau, și a fost adăugat la mâncare.
Când această soluție intră în contact cu carnea, aluminiul este fixat în constituenții săi sub forma unui compus care este insolubil în apă clocotită, dar care se dizolvă în sucuri gastrice aproximativ 80%.
Încă din 1904 se știa că sărurile de aluminiu încetinesc digestia, atât în stomac, cât și în intestine. Prin urmare, este o practică nedorită să adăugați soluții de acetat de aluminiu la conservele alimentare..

Efecte dăunătoare
Deoarece există studii care raportează că acetat de aluminiu poate fi toxic, au fost efectuate teste în care șoarecii de laborator au fost injectați cu acetat de aluminiu.
Rezultatele indică faptul că acest compus provoacă daune coloanei vertebrale a animalelor menționate, precum și daune cromozomilor și spermei animalelor. Cu alte cuvinte, este genotoxic.
Acest lucru vă avertizează cu privire la potențialele pericole pentru sănătate care ar putea fi cauzate de supraexpunerea la acetat de aluminiu și la îngrijirea care trebuie luată în timpul utilizării acestuia..
Referințe
- Mac-Kay Chace, E. (1904). Utilizarea acetatului de aluminiu de bază ca conservant în cârnați. Jurnalul American Chemical Society 1904, 26, 6: 662-665. Recuperat de la pubs.acs.org.
- Hood, G.C. și Ihde, A.J. (1950). Acetați și propioniți de aluminiu - Pregătirea și compoziția lor. Jurnalul American Chemical Society 1950, 72, 5: 2094-2095. Recuperat de la pubs.acs.org.
- Pitaro, J. și colab. (2013). Ototoxicitatea soluției otice de acetat de aluminiu / clorură de benzenetoniu în modelul animal Chinchilla. Laringoscop, 2013; 123 (10): 2521-5. Recuperat de la ncbi.nlm.nih.gov.
- Thorp, M.A. și colab. (2000). Soluția Burow în tratamentul otitei medii supurative cronice mucoase active: determinarea unei diluții eficiente. Jurnalul de laringologie și otologie, iunie 2000, vol. 114, pp. 432-436. Recuperat de la ncbi.nlm.nih.gov.
- D'Souza, domnule P. și colab. (2014). Evaluarea genotoxicității acetatului de aluminiu în măduva osoasă, celulele germinale masculine și celulele hepatice fetale ale șoarecilor albini elvețieni. Mutation Research 766 (2014) 16-22. Recuperat de la ncbi.nlm.nih.gov.
- Basal, Y. și colab. (2015). Efectele soluțiilor topice Burow și Castellani asupra mucoasei urechii mijlocii a șobolanilor. J. Int Adv Otol 2015; 11 (3): 253-6. Recuperat de la advancedotology.org.
- S.U.A. Biblioteca Națională de Medicină. (2019). Acetat de aluminiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. și Leffler, S.M. (2012). Arsuri solare. Ce să fac. În situații de urgență minoră (ediția a treia). Recuperat de la sciencedirect.com.
- Thompson, E. și Kalus, A. (2017). Reacții cutanate acute și infecții bacteriene. Tratament. În Manualul de călătorie și medicina tropicală (ediția a cincea). Recuperat de la sciencedirect.com.
- Kim, T. și colab. (2010). Sinteza controlabilă a morfologiei nanostructurilor gamma-alumină printr-o cale hidrotermală asistată de lichide ionice. Crystal Growth & Design, Vol. 10, No. 7, 2010, pp. 2928-2933. Recuperat de la pubs.acs.org.
- Rajala, J.W. și colab. (2015). Core-Shell Electrospun Fibre ceramice de oxid de aluminiu gol. Fibre 2015, 3, 450-462. Recuperat de la mdpi.com.



Nimeni nu a comentat acest articol încă.