
Ce sunt elementele diatomice? (Exemple)
elemente diatomice, De asemenea, numite molecule diatomice homonucleare, acestea sunt alcătuite din doar doi atomi din aceleași elemente chimice. Unele elemente nu pot exista singure, chiar și atunci când sunt izolate de orice alt tip de atom.
Elementele de această natură se vor combina cu atomi din același element pentru a fi stabile. Cu alte cuvinte, hidrogenul, un element diatomic, nu poate fi de la sine. Nu poate exista pur și simplu H.
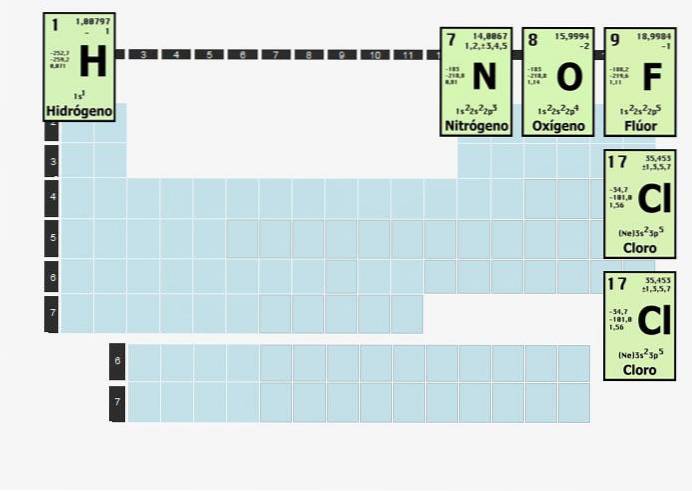
Hidrogenul este atât de reactiv încât, atunci când este izolat de orice, în afară de hidrogen, se va combina într-o moleculă diatomică (cu doi atomi). Prin urmare, hidrogenul gazos, care este uneori folosit ca combustibil, există ca HDouă.
Molecule diatomice
Moleculele diatomice conțin doi atomi care sunt legați chimic. Dacă cei doi atomi sunt identici, cum ar fi molecula de oxigen (ODouă), formează o moleculă diatomică homonucleară, în timp ce dacă atomii sunt diferiți, ca și în molecula de monoxid de carbon (CO), formează o moleculă diatomică heteronucleară.
Moleculele care conțin mai mult de doi atomi se numesc molecule poliatomice, de exemplu, dioxid de carbon (CODouă) și apă (HDouăSAU). Moleculele de polimer pot conține multe mii de atomi componenți.
Există șapte elemente care alcătuiesc moleculele diatomice. Următoarele 5 gaze elemente se găsesc ca molecule diatomice la temperatura camerei și presiune:
-Hidrogen - HDouă
-Azot - NDouă
-Oxigen - ODouă
-Fluor - FDouă
-Clor - ClDouă
Bromul și iodul există în mod obișnuit sub formă lichidă, dar și ca gaze diatomice la temperaturi ușor mai ridicate, ceea ce face un total de 7 elemente diatomice..
-Brom - BrDouă
-Iod - euDouă
Elementele diatomice sunt halogeni (fluor, clor, brom, iod) și elemente cu terminație -gen (hidrogen, oxigen, azot). Astatinul este un alt halogen, dar comportamentul său este necunoscut..
Proprietățile elementelor diatomice
Toate moleculele diatomice sunt liniare, ceea ce este cel mai simplu aranjament spațial al atomilor.
Este convenabil și obișnuit să se reprezinte o moleculă diatomică ca două mase punctuale (cei doi atomi) conectați printr-un arc fără masă..
Energiile implicate în mișcările moleculei pot fi împărțite în trei categorii:
- Energiile de translație (molecula care se deplasează din punctul A în punctul B)
- Energiile de rotație (molecula care se rotește în jurul axei sale)
- Energiile vibraționale (molecule care vibrează într-o varietate de moduri)
Toate elementele diatomice sunt gaze la temperatura camerei, cu excepția bromului și a iodului care sunt lichide (iodul poate fi chiar în stare solidă) și toate, cu excepția oxigenului și a azotului, sunt legate printr-o singură legătură..
Molecula de oxigen are cei doi atomi uniți printr-o legătură dublă și molecula de azot printr-o legătură triplă.
Unele elemente diatomice
Hidrogen
Hidrogen (HDouă), cu un număr atomic de 1, este un gaz incolor care nu a fost descoperit formal ca element de Henry Cavendish până în 1766, dar a fost găsit accidental cu aproximativ o sută de ani mai devreme de Robert Boyle.
Este un gaz incolor, inodor, netoxic care există în mod natural în Universul nostru. Fiind primul element din tabelul periodic, hidrogenul este cel mai ușor și mai abundent dintre toate elementele chimice din univers, deoarece reprezintă 75% din masa sa..
Azot
Azot (NDouă) are un număr atomic de șapte și reprezintă aproximativ 78,05% din atmosfera Pământului în volum.
Este un gaz inodor, incolor și mai ales inert și rămâne incolor și inodor în stare lichidă..

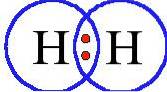
Oxigen
Oxigen (ODouă) are un număr atomic de opt. Acest gaz incolor, inodor are opt protoni în nucleu și este albastru pal în stările sale lichide și solide..
O cincime din atmosfera Pământului este alcătuită din oxigen și este al treilea cel mai abundent element din univers prin masă..
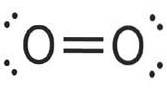
Oxigenul este cel mai abundent element în masă din biosfera Pământului. Concentrația ridicată de oxigen din atmosferă este rezultatul ciclului de oxigen al Pământului, care este condus în principal de fotosinteza plantelor..
Fluor
Fluor (FDouă) are un număr atomic de nouă și este cel mai reactiv și electronegativ dintre toate elementele. Acest element nemetalic este un gaz galben pal care face parte din grupul halogen.
George Gore a fost aparent primul om de știință care a izolat fluorul, dar experimentul său a explodat când fluorul produs a reacționat cu hidrogenul..
În 1906, Ferdinand Frederic Henri Moissan a primit Premiul Nobel pentru chimie pentru munca sa privind izolarea fluorului în 1886. Este cel mai electronegativ element din tabelul periodic..
Clor
Clor (ClDouă) este un membru al grupului halogen cu un număr atomic de șaptesprezece. Una dintre formele sale, NaCl, a fost folosită din cele mai vechi timpuri.

Clorul este utilizat de mii de ani sub multe alte forme, dar nu a fost numit până în 1810 de Sir Humphry Davy..
Clorul în forma sa pură este de culoare verde gălbuie, dar compușii săi obișnuiți sunt de obicei incolori..
Brom
Brom (BrDouă) are un număr atomic de treizeci și cinci. Este un lichid greu de culoare maro închis, singurul element nemetalic care este un lichid.

Bromul a fost descoperit de Antoine J. Balard în 1826. A fost folosit în scopuri importante cu mult înainte de a fi descoperit formal..
Iod
Iod (IDouă) are un număr atomic de cincizeci și trei, cu cincizeci și trei de protoni în nucleul unui atom. Este un nemetal albastru-negru care joacă un rol foarte important în chimia organică..
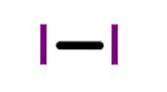
Iodul a fost descoperit în 1811 de Barnard Courtois. El l-a numit iod din cuvântul grecesc „iodes” care înseamnă violet. Este un albastru-negru solid.
Iodul joacă un rol foarte important în biologia tuturor organismelor vii, deoarece deficiența sa duce la boli precum hipertiroidismul și hipotiroidismul.
Referințe
- (S.F.). Molecule diatomice homonucleare. Recuperat de la boundless.com.
- Fapte despre clor. (S.F.). Recuperat de pe softschools.com.
- Elemente diatomice. (S.F.). Recuperat de pe ths.talawanda.org.
- Encyclopædia Britannica. (2016, 14 septembrie). Moleculă. Recuperat de la britannica.com.
- Helmenstine, A. (2014, 28 septembrie). Elemente diatomice. Recuperat de la sciencenotes.org.
- Helmenstine, A. M. (2017, 29 martie). Care sunt cele șapte elemente diatomice? Recuperat de la thoughtco.com.
- Fapte despre oxigen. (S.F.). Recuperat de pe softschools.com.
- Societatea Regală de Chimie. (2015). iod molecular. Recuperat de la chemspider.com.


Nimeni nu a comentat acest articol încă.