
Tipuri și exemple de reacție de substituție dublă

reacție de substituție dublă, dubla deplasare sau metateză, este una în care are loc un dublu schimb ionic între doi compuși, fără ca niciunul dintre aceștia să fie oxidat sau redus. Constituie una dintre cele mai elementare reacții chimice.
Noile legături sunt formate de marile forțe de atracție electrostatice dintre ioni. La fel, reacția favorizează formarea celor mai stabile specii, în special a moleculei de apă. Imaginea de mai jos ilustrează ecuația chimică generală pentru reacția de dublă substituție..
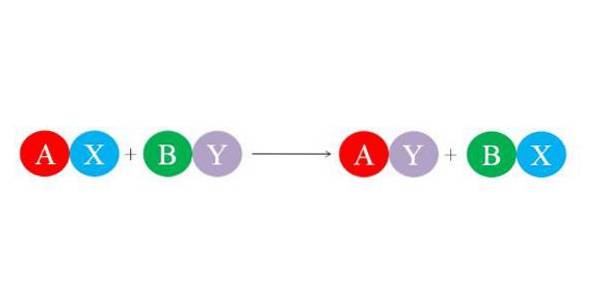
Compușii inițiali AX și BY reacționează schimbând „partenerii lor” și formează astfel doi compuși noi: AY și BX. Această reacție apare dacă și numai dacă A și Y sunt mai înrudite decât A și B sau dacă legăturile BX sunt mai stabile decât cele ale BY. Deoarece reacția este un schimb ionic simplu, nici ionul nu câștigă sau pierde electroni (reacție redox).
Astfel, dacă A este un cation cu +1 sarcină în compusul AX, va avea aceeași sarcină +1 în compusul AY. Același lucru este valabil și pentru restul „literelor”. Acest tip de reacție susține reacțiile acido-bazice și formarea precipitatelor..
Indice articol
- 1 Tipuri
- 1.1 Neutralizare
- 1.2 Precipitații
- 2 Exemple
- 2.1 Exemplul 1
- 2.2 Exemplul 2
- 2.3 Exemplul 3
- 2.4 Exemplul 4
- 2.5 Exemplul 5
- 2.6 Exemplul 6
- 2.7 Exemplul 7
- 2.8 Exemplul 8
- 3 Referințe
Tipuri
Neutralizare
Un acid puternic reacționează cu o bază puternică pentru a produce săruri solubile și apă. Când unul dintre cei doi - acidul sau baza - este slab, sarea produsă nu este complet ionizată; adică într-un mediu apos capabil să se hidrolizeze. În mod similar, acidul sau baza pot fi neutralizate cu o sare..
Cele de mai sus pot fi din nou reprezentate de ecuația chimică cu literele AXBY. Cu toate acestea, deoarece aciditatea Brønsted este indicată numai de ioni H+ și OH-, Acestea vin apoi să reprezinte literele A și Y:
HX + BOH => HOH + BX
Această ecuație chimică corespunde neutralizării, care este pur și simplu reacția dintre un acid HX și o bază BOH pentru a produce HOH (HDouăO) și sarea BX, care poate fi sau nu solubilă în apă.
Scheletul său poate varia în funcție de coeficienții stoichiometrici sau de natura acidului (dacă este organic sau anorganic).
Precipitare
În acest tip de reacție, unul dintre produse este insolubil în mediu, în general apos și precipită (solidul se depune din restul soluției).
Schema este după cum urmează: doi compuși solubili, AX și BY, sunt amestecați și unul dintre produse, AY sau BX, precipită, care va depinde de regulile de solubilitate:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
În cazul în care atât AY cât și BX sunt insolubile în apă, va precipita perechea de ioni care prezintă cele mai puternice interacțiuni electrostatice, care pot fi reflectate cantitativ în valorile lor de constante de solubilitate (Kps).
Cu toate acestea, în majoritatea reacțiilor de precipitare, o sare este solubilă, iar cealaltă precipită. Ambele reacții - neutralizare și precipitații - pot apărea în același amestec de substanțe.
Exemple
Exemplul 1
HCI (aq) + NaOH (aq) => HDouăO (l) + NaCI (aq)
Ce fel de reacție este aceasta? Acidul clorhidric reacționează cu hidroxidul de sodiu, generând în consecință apă și clorură de sodiu. Datorită faptului că NaCl este foarte solubil în mediu apos și că s-a format și o moleculă de apă, reacția din Exemplul 1 este neutralizarea.
Exemplul 2
Timbru3)Două(ac) + NaDouăS (ac) => CuS (s) + 2NaNO3(ac)
Nici ionul H nu este prezent în această reacție+ nici OH-, și nici molecula de apă nu este observată în partea dreaptă a ecuației chimice.
Azotatul de cupru (II) sau azotatul cupric schimbă ioni cu sulfură de sodiu. Sulfura de cupru este insolubilă, precipitând spre deosebire de nitratul de sodiu, sare solubilă.
Soluția de Cu (NO3)Două este albăstrui, în timp ce NaDouăS este gălbuie. Când ambele sunt amestecate, culorile dispar și precipită CuS, care este un solid negricios..
Exemplul 3
CH3COOH (aq) + NaOH (aq) => CH3COONa (ac) + HDouăO (l)
Din nou, aceasta este o altă reacție de neutralizare. Acidul acetic reacționează cu hidroxid de sodiu pentru a forma sarea de acetat de sodiu și o moleculă de apă.
Spre deosebire de exemplul 1, acetat de sodiu nu este o sare complet ionizată, deoarece anionul este hidrolizat:
CH3GÂNGURI-(ac) + HDouăO (l) <=> CH3COOH (aq) + OH-(ac)
Exemplul 4
2HI (ac) + CaCO3(s) => HDouăCO3(ac) + CaIDouă(ac)
În această reacție - care, deși nu pare a fi neutralizare - acidul hidroiodic reacționează complet cu calcarul pentru a genera acid carbonic și iodură de calciu. În plus, evoluția căldurii (reacție exotermă) descompune acidul carbonic în dioxid de carbon și apă:
HDouăCO3(ac) => CODouă(g) + HDouăO (l)
Reacția generală este următoarea:
2HI (ac) + CaCO3(s) => CODouă(g) + HDouăO (l) + CaIDouă(ac)
La fel, carbonatul de calciu, o sare bazică, neutralizează acidul hidroiodic.
Exemplul 5
AgNO3(aq) + NaCI (aq) => AgCl (s) + NaNO3(ac)
Azotatul de argint schimbă ioni cu clorură de sodiu, formând astfel sarea insolubilă clorură de argint (precipitat albicios) și azotat de sodiu..
Exemplul 6
2H3PO4(ac) + 3Ca (OH)Două(ac) => 6HDouăO (l) + Ca3(PO4)Două(s)
Acidul fosforic este neutralizat de hidroxid de calciu, formând în consecință fosfatul de calciu sare insolubil și șase moli de molecule de apă..
Acesta este un exemplu de reacție de dublă substituție de ambele tipuri: neutralizarea acidului și precipitarea unei sări insolubile..
Exemplul 7
KDouăS (ac) + MgSO4(ac) => KDouăSW4(ac) + MgS (s)
Sulfura de potasiu reacționează cu sulfatul de magneziu, adunând ionii S în soluțieDouă- și MgDouă+ pentru a forma sarea insolubilă a sulfurii de magneziu și sarea solubilă a sulfatului de potasiu.
Exemplul 8
N / ADouăS (aq) + HCI (aq) → NaCI (aq) + HDouăS (g)
Sulfura de sodiu neutralizează acidul clorhidric, generând clorură de sodiu și hidrogen sulfurat.
În această reacție, apa nu se formează (spre deosebire de cele mai frecvente neutralizări), ci molecula non-electrolitică sulfură de hidrogen, al cărei miros de ouă putrede este foarte neplăcut. HDouăS scapă de soluție sub formă gazoasă, iar restul speciilor rămân dizolvate.
Referințe
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Learning, p 150-155.
- Quimicas.net (2018). Exemple de reacție de dublă substituție. Adus pe 28 mai 2018, de pe: quimicas.net
- Reacții de metateză. Adus pe 28 mai 2018, de pe: science.uwaterloo.ca
- Academia Khan. (2018). Reacții duble de înlocuire. Adus pe 28 mai 2018, de pe: khanacademy.org
- Helmenstine, Anne Marie, dr. (8 mai 2016). Definiție reacție dublă înlocuire. Adus pe 28 mai 2018, de pe: thoughtco.com


Nimeni nu a comentat acest articol încă.