
Caracteristici ale reacției endergonice, exemple
A reacție endergonică Este una care nu se poate întâmpla spontan și necesită, de asemenea, o sursă mare de energie. În chimie, această energie este în general calorică. Cele mai cunoscute dintre toate reacțiile endergonice sunt reacțiile endotermice, adică cele care absorb căldura care are loc.
De ce nu sunt toate reacțiile spontane? Pentru că merg în sus la legile termodinamicii: consumă energie și sistemele formate de speciile implicate își scad entropia; adică, în scopuri chimice, acestea devin mai ordonate molecular.

Construirea unui zid de cărămidă este un exemplu de reacție endergonică. Cărămizile singure nu se compactează suficient pentru a forma un corp solid. Acest lucru se datorează faptului că nu există un câștig de energie care să le promoveze uniunile (reflectat și în posibilele lor interacțiuni intermoleculare scăzute).
Așadar, pentru a construi zidul aveți nevoie de ciment și de forță de muncă. Aceasta este energie, iar reacția non-spontană (peretele nu va fi construit automat) devine posibilă dacă se percepe un beneficiu energetic (economic, în cazul peretelui).
Dacă nu există niciun beneficiu, peretele se va prăbuși sub orice perturbare, iar cărămizile sale nu vor putea ține niciodată împreună. Același lucru este valabil și pentru mulți compuși chimici, ale căror elemente de bază nu se pot uni spontan..
Indice articol
- 1 Caracteristicile unei reacții endergonice
- 1.1 Crește energia liberă a sistemului
- 1.2 Legăturile dvs. de produse sunt mai slabe
- 1.3 Este cuplat cu reacții exergonice
- 2 Exemple
- 2.1 Fotosinteza
- 2.2 Sinteza biomoleculelor și macromoleculelor
- 2.3 Formarea diamantelor și a compușilor grei din țiței
- 3 Referințe
Caracteristicile unei reacții endergonice
Ce se întâmplă dacă zidul poate fi construit spontan? Pentru aceasta, interacțiunile dintre cărămizi trebuie să fie foarte puternice și stabile, atât de mult încât niciun ciment sau o persoană nu va trebui să le comande; în timp ce peretele de cărămidă, deși este rezistent, este cimentul întărit care îi ține împreună și nu în mod corespunzător materialul cărămizilor.
Prin urmare, primele caracteristici ale unei reacții endergonice sunt:
-Nu este spontan
-Absoarbe căldura (sau altă energie)
Și de ce absoarbe energia? Deoarece produsele sale au mai multă energie decât reactanții implicați în reacție. Aceasta poate fi reprezentată de următoarea ecuație:
ΔG = GProduse-GReactivi
Unde ΔG este schimbarea energiei libere Gibbs. Ca GProdus este mai mare (deoarece este mai energic) decât GReactivi, scăderea trebuie să fie mai mare decât zero (ΔG> 0). Următoarea imagine rezumă în continuare ceea ce tocmai a fost explicat:
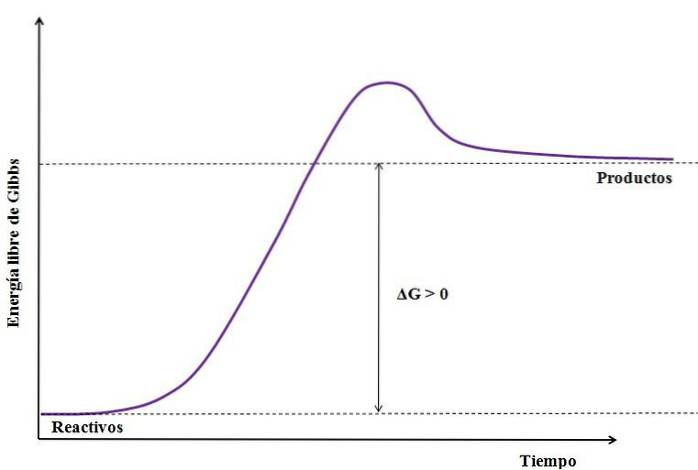
Observați diferența dintre stările de energie dintre produse și reactanți (linia purpurie). Prin urmare, reactanții nu devin produse (A + B => C) dacă nu există mai întâi o absorbție a căldurii..
Crește energia liberă a sistemului
Fiecare reacție endergonică este asociată cu o creștere a energiei libere Gibbs a sistemului. Dacă pentru o anumită reacție este satisfăcut că ΔG> 0, atunci nu va fi spontan și va necesita o alimentare cu energie..
Cum se știe matematic dacă o reacție este sau nu endergonică? Aplicând următoarea ecuație:
ΔG = ΔH-TΔS
Unde ΔH este entalpia reacției, adică energia totală eliberată sau absorbită; ΔS este modificarea entropiei, iar T este temperatura. Factorul TΔS este pierderea de energie neutilizată în expansiunea sau aranjarea moleculelor într-o fază (solid, lichid sau gazos).
Astfel, ΔG este energia pe care sistemul o poate folosi pentru a lucra. Deoarece ΔG are un semn pozitiv pentru o reacție endergonică, energia sau munca trebuie aplicate sistemului (reactanților) pentru a obține produsele.
Apoi, cunoscând valorile lui ΔH (pozitiv, pentru o reacție endotermă și negativ, pentru o reacție exotermă) și TΔS, este posibil să știm dacă reacția este endergonică. Aceasta înseamnă că, deși o reacție este endotermă, nu este neapărat endergonic.
Cubul de gheață
De exemplu, un cub de gheață se topește în apă lichidă, absorbind căldura, ceea ce ajută la separarea moleculelor sale; cu toate acestea, procesul este spontan și, prin urmare, nu este o reacție endergonică.
Și cum rămâne cu situația în care doriți să topiți gheața la o temperatură mult sub -100ºC? În acest caz, termenul TΔS din ecuația energiei libere devine mic în comparație cu ΔH (deoarece T scade) și, ca rezultat, ΔG va avea o valoare pozitivă.
Cu alte cuvinte: topirea gheții sub -100ºC este un proces endergonic și nu este spontan. Un caz similar este cel al înghețării apei în jurul valorii de 50 ° C, ceea ce nu se întâmplă spontan..
Legăturile dvs. de produse sunt mai slabe
O altă caracteristică importantă, legată și de ΔG, este energia noilor legături. Legăturile produselor formate sunt mai slabe decât cele ale reactanților. Cu toate acestea, scăderea puterii legăturilor este compensată de un câștig în masă, care se reflectă în proprietățile fizice.
Aici comparația cu zidul de cărămidă începe să-și piardă sensul. Conform celor de mai sus, legăturile din cărămizi trebuie să fie mai puternice decât cele dintre ele și ciment. Cu toate acestea, peretele în ansamblu este mai rigid și mai rezistent datorită masei sale mai mari..
Ceva similar va fi explicat în secțiunea de exemple, dar cu zahăr.
Este cuplat cu reacții exergonice
Dacă reacțiile endergonice nu sunt spontane, cum au loc în natură? Răspunsul se datorează cuplării cu alte reacții care sunt destul de spontane (exergonice) și care promovează cumva dezvoltarea lor..
De exemplu, următoarea ecuație chimică reprezintă acest punct:
A + B => C (reacție endergonică)
C + D => E (reacție exergonică)
Prima reacție nu este spontană, deci nu poate apărea în mod natural. Cu toate acestea, producția de C permite să apară a doua reacție, provocând E.
Adăugarea energiilor libere Gibbs pentru cele două reacții, ΔG1 și ΔGDouă, cu un rezultat mai mic de zero (ΔG<0), entonces el sistema presentará un incremento de la entropía y por lo tanto será espontáneo.
Dacă C nu a reacționat cu D, A nu ar putea să-l formeze niciodată, deoarece nu există compensare energetică (ca în cazul banilor cu zidul de cărămidă). Se spune apoi că C și D „trag” A și B pentru a reacționa, chiar dacă este o reacție endergonică..
Exemple

Fotosinteză
Plantele folosesc energia solară pentru a crea carbohidrați și oxigen din dioxid de carbon și apă. CODouă pe mineDouă, moleculele mici, cu legături puternice, formează zaharuri, cu structuri inelare, care sunt mai grele, mai solide și se topesc la o temperatură de aproximativ 186ºC..
Rețineți că legăturile C-C, C-H și C-O sunt mai slabe decât cele ale O = C = O și O = O. Și dintr-o unitate de zahăr, planta poate sintetiza polizaharide, cum ar fi celuloza.
Sinteza biomoleculelor și macromoleculelor
Reacțiile endergonice fac parte din procesele anabolice. Ca și carbohidrații, alte biomolecule, cum ar fi proteinele și lipidele, necesită mecanisme complexe care, fără ele, și cuplarea cu reacția de hidroliză a ATP, nu ar putea exista.
La fel, procesele metabolice precum respirația celulară, difuzia ionilor prin membranele celulare și transportul oxigenului prin fluxul sanguin sunt exemple de reacții endergonice..
Formarea diamantelor și a compușilor grei din țiței
Diamantele necesită presiuni și temperaturi enorme, astfel încât componentele lor pot fi compactate într-un solid cristalin..
Cu toate acestea, unele cristalizări sunt spontane, deși apar la viteze foarte mici (spontaneitatea nu are nicio legătură cu cinetica reacției).
În cele din urmă, țițeiul însuși reprezintă un produs al reacțiilor endergonice, în special hidrocarburile grele sau macromoleculele numite asfaltene..
Structurile lor sunt foarte complexe, iar sinteza lor durează mult timp (milioane de ani), căldură și acțiune bacteriană..
Referințe
- QuimiTube. (2014). Reacții endergonice și exergonice. Recuperat de pe: quimitube.com
- Academia Khan. (2018). Energie gratis. Recuperat de pe: es.khanacademy.org
- Dicționar de biologie. (2017). Definiția endergonic reaction. Recuperat de pe: biologydictionary.net
- Lougee, Mary. (18 mai 2018). Ce este o reacție endergonică? Știința. Recuperat de pe: sciencing.com
- Helmenstine, Anne Marie, dr. (22 iunie 2018). Endergonic vs Exergonic (Cu exemple). Recuperat de pe: thoughtco.com
- Arrington D. (2018). Reacție endergonică: definiție și exemple. Studiu. Recuperat de la: study.com
- Audersirk Byers. (2009). Viața pe Pământ. Ce este energia? [PDF]. Recuperat de la: hhh.gavilan.edu



Nimeni nu a comentat acest articol încă.