
Reacții chimice caracteristice, părți, tipuri, exemple

reacții chimice Sunt modificări pe care le suferă materia în aranjarea atomilor săi și au loc atunci când două substanțe sau compuși diferiți intră în contact. Modificările au originea în procesul care poate fi văzut imediat; cum ar fi o creștere a temperaturii, răcirea, formarea gazului, sclipirea sau precipitarea unui solid.
Cele mai frecvente reacții chimice trec adesea neobservate în viața de zi cu zi; mii dintre ele sunt efectuate în corpurile noastre. Cu toate acestea, altele sunt mai vizibile, deoarece le putem face în bucătărie selectând ustensilele și ingredientele corecte; de exemplu, amestecarea bicarbonatului de sodiu cu oțet, topirea zahărului în apă sau acidificarea sucului de varză purpurie.

În laboratoare, reacțiile chimice devin mai frecvente și mai frecvente; toate apar în pahare sau în baloane Erlenmeyer. Dacă împărtășesc ceva în comun, este că niciunul dintre ele nu este simplu, deoarece ascund coliziuni, pauze de legătură, mecanisme, formare de legături, energie și aspecte cinetice..
Există reacții chimice atât de izbitoare, încât amatorii și oamenii de știință, cunoscând toxicologia reactivilor și unele măsuri de siguranță, le reproduc pe scări mari în evenimente demonstrative fascinante..
Indice articol
- 1 Conceptul de reacție chimică
- 2 Caracteristicile reacțiilor chimice
- 2.1 Cinetica
- 2.2 Conservarea aluatului
- 2.3 Schimbări fizice și / sau schimbări de stare
- 2.4 Variația culorii
- 2.5 Eliberarea gazelor
- 2.6 Schimbări de temperatură
- 3 Părți ale unei reacții chimice
- 3.1 Reactivi și produse
- 3.2 Medii de reacție
- 3.3 Vase sau reactoare
- 4 Tipuri de reacții chimice
- 4.1 - Reducerea oxidării (redox)
- 4.2 - Sinteza
- 4.3 - Descompunerea
- 4.4 - Deplasare
- 4.5 - Formarea gazului
- 4.6 - Metateză sau dublă deplasare
- 5 Exemple de reacții chimice
- 5.1 Derulare
- 5.2 Neutralizare
- 5.3 Defilare dublă
- 5.4 Redox
- 6 Exerciții de reacții chimice rezolvate
- 6.1 - Exercițiul 1
- 6.2 - Exercițiul 2
- 6.3 - Exercițiul 3
- 7 Referințe
Conceptul de reacție chimică
Reacțiile chimice au loc atunci când se rupe o legătură (ionică sau covalentă), astfel încât se formează alta în locul ei; doi atomi sau un set de aceștia încetează să interacționeze puternic pentru a genera molecule noi. Datorită acestui fapt, pot fi determinate proprietățile chimice ale unui compus, reactivitatea acestuia, stabilitatea, cu ceea ce reacționează.
Pe lângă faptul că sunt responsabili pentru reacțiile chimice pe care materia le transformă în mod constant, fără a-i afecta atomii, ele explică apariția compușilor așa cum îi cunoaștem..
Energia este necesară pentru ca legăturile să se rupă, iar atunci când se formează legături, aceasta este eliberată. Dacă energia absorbită este mai mare decât cea eliberată, se spune că reacția este endotermă; avem o răcire a împrejurimilor. Întrucât dacă căldura degajată este mai mare decât cea absorbită, atunci va fi o reacție exotermă; împrejurimile se încing.
Caracteristicile reacțiilor chimice

Cinetică
Teoretic, moleculele trebuie să se ciocnească, purtând cu ele suficientă energie cinetică pentru a favoriza ruperea unei legături. Dacă coliziunile lor sunt lente sau ineficiente, reacția chimică este afectată cinetic. Acest lucru se poate produce fie prin stările fizice ale substanțelor, fie prin geometria sau structura lor..
Astfel, într-o reacție, materia se transformă prin absorbția sau eliberarea căldurii, în același timp suferă coliziuni care favorizează formarea produselor; cele mai importante componente ale oricărei reacții chimice.
Conservarea aluatului
Datorită legii conservării masei, masa totală a ansamblului rămâne constantă după o reacție chimică. Astfel, suma maselor individuale ale fiecărei substanțe este egală cu masa rezultatului obținut.
Schimbări fizice și / sau schimbări de stare
Apariția unei reacții chimice poate fi însoțită de o modificare a stării componentelor; adică o variație a stării solide, lichide sau gazoase a materialului.
Cu toate acestea, nu toate schimbările de stare implică o reacție chimică. De exemplu: dacă apa se evaporă datorită efectului căldurii, vaporii de apă produși după această schimbare de stare sunt încă apă.
Variația culorii
Dintre atributele fizice care rezultă dintr-o reacție chimică, se remarcă schimbarea culorii reactivilor față de culoarea produsului final..
Acest fenomen se observă atunci când se observă reacția chimică a metalelor cu oxigenul: atunci când un metal se oxidează, își schimbă culoarea caracteristică (auriu sau argintiu, după caz), pentru a transforma o nuanță roșiatică-portocalie, cunoscută sub numele de rugină..
Eliberarea de gaze
Această caracteristică se manifestă ca o barbotare sau cu emisia de mirosuri particulare.
În general, bulele apar ca o consecință a supunerii unui lichid la temperaturi ridicate, ceea ce incită la o creștere a energiei cinetice a moleculelor care fac parte din reacție..
Schimbări de temperatură
În cazul în care căldura este un catalizator pentru reacția chimică, o modificare a temperaturii va fi indusă în produsul final. Prin urmare, intrarea și ieșirea căldurii în proces pot fi, de asemenea, o caracteristică a reacțiilor chimice..
Părți ale unei reacții chimice
Reactivi și produse
Orice reacție chimică este reprezentată de o ecuație de tipul:
A + B → C + D
Unde A și B sunt reactanții, în timp ce C și D sunt produsele. Ecuația ne spune că atomul sau molecula A reacționează cu B pentru a provoca produsele C și D. Aceasta este o reacție ireversibilă, deoarece reactanții nu pot proveni din nou din produse. Pe de altă parte, reacția de mai jos este reversibilă:
A + B <=> C + D
Este important să subliniem că masa reactanților (A + B) trebuie să fie egală cu masa produselor (C + D). În caz contrar, aluatul nu s-ar păstra. În mod similar, numărul de atomi pentru un anumit element trebuie să fie același înainte și după săgeată.
Deasupra săgeții sunt indicate câteva specificații specifice ale reacției: temperatura (Δ), incidența radiațiilor ultraviolete (hv), sau catalizator folosit.
Medii de reacție
În ceea ce privește viața și reacțiile care apar în corpul nostru, mediul de reacție este apos (ac). Cu toate acestea, reacțiile chimice pot avea loc în orice mediu lichid (etanol, acid acetic glacial, toluen, tetrahidrofuran etc.) atâta timp cât reactivii sunt bine dizolvați..
Vase sau reactoare
Reacțiile chimice controlate apar într-un vas, fie o simplă sticlărie, fie într-un reactor din oțel inoxidabil.
Tipuri de reacții chimice
Tipurile de reacții chimice se bazează pe ceea ce se întâmplă la nivel molecular; ce legături sunt rupte și cum ajung să se unească atomii. De asemenea, se ia în considerare dacă speciile câștigă sau pierd electroni; chiar dacă în majoritatea reacțiilor chimice se produce acest lucru.
Aici explicăm diferitele tipuri de reacții chimice care există.
- Reducerea oxidării (redox)
Oxidarea cuprului
În exemplul patinei are loc o reacție de oxidare: cuprul metalic pierde electroni în prezența oxigenului pentru a se transforma în oxidul său corespunzător.
4Cu (s) + ODouă(g) => CuDouăTu)
Oxidul de cupru (I) continuă să se oxideze până la oxidul de cupru (II):
2CuDouăO (s) + ODouă => 4CuO (s)
Acest tip de reacție chimică în care specia crește sau reduce numărul (sau starea) lor de oxidare, este cunoscut sub numele de reacție de oxidare și reducere (redox)..
Cuprul metalic cu stare de oxidare 0, mai întâi pierde un electron, iar apoi al doilea (se oxidează), în timp ce oxigenul rămâne (se reduce):
Cu => Cu+ + și-
Cu+ => CuDouă+ + și-
SAUDouă + 2e- => 2ODouă-
Câștigul sau pierderea de electroni poate fi determinat prin calcularea numerelor de oxidare pentru atomii din formulele chimice ale compușilor lor rezultați..
Pentru CuDouăSau, se știe că, deoarece este un oxid, avem anionul ODouă-, Prin urmare, pentru a menține sarcinile neutralizate, fiecare dintre cei doi atomi de cupru trebuie să aibă o sarcină de +1. Foarte similar se întâmplă cu CuO.
Când cuprul se oxidează, acesta capătă numere de oxidare pozitive; și oxigen, care urmează să fie redus, numere de oxidare negative.
Fier și cobalt
Exemple suplimentare pentru reacțiile redox sunt prezentate mai jos. De asemenea, se va face un scurt comentariu și se vor specifica modificările numerelor de oxidare..
FeClDouă + CoCl3 => FeCl3 + CoClDouă
Dacă se calculează numerele de oxidare, se va observa că cele ale lui Cl rămân cu o valoare constantă de -1; nu așa, cu cele ale Fe y Co.
La prima vedere, fierul a fost oxidat, în timp ce cobaltul a fost redus. De unde știți? Deoarece fierul nu interacționează acum cu doi anioni Cl- dar cu trei, atomul de clor (neutru) fiind mai electronegativ decât fierul și cobaltul. Pe de altă parte, opusul se întâmplă cu cobaltul: trece de la interacțiunea cu trei Cl- doi dintre ei.
Dacă raționamentul de mai sus nu este clar, atunci vom continua să scriem ecuațiile chimice ale transferului net de electroni:
CredinţăDouă+ => Credință3+ + și-
Co3+ + și- => CoDouă+
Prin urmare, FeDouă+ ruginește, în timp ce Co3+ este redus.
Iod și mangan
6KMnO4 + 5KI + 18HCl => 6MnClDouă + 5KIO3 + 6KCI + 9HDouăSAU
Ecuația chimică de mai sus poate părea complicată, dar nu este. Clor (Cl-) sau oxigen (ODouă-) experimentează câștigul sau pierderea electronilor lor. Iod și mangan, da.
Având în vedere doar compușii cu iod și mangan, avem:
KI => KIO3 (numărul de oxidare: -1 la +5, pierde șase electroni)
KMnO4 => MnClDouă (numărul de oxidare: +7 până la +2, câștigă cinci electroni)
Iodul este oxidat, în timp ce manganul este redus. Cum să știi fără să faci calcule? Deoarece iodul trece de la a fi cu potasiu la a interacționa cu trei oxigeni (mai electronegativi); iar manganul, la rândul său, pierde interacțiunile cu oxigenul pentru a fi cu clorul (mai puțin electronegativ).
KI nu poate pierde șase electroni dacă KMnO4 câștigă cinci; de aceea, numărul de electroni trebuie echilibrat în ecuație:
5 (KI => KIO3 + 6e-)
6 (KMnO4 + 5e- => MnClDouă)
Ceea ce are ca rezultat un transfer net de 30 de electroni.
Combustie
Arderea este o oxidare energică și energică în care se eliberează lumină și căldură. În general, la acest tip de reacție chimică oxigenul participă ca agent oxidant sau oxidant; în timp ce agentul reducător este combustibilul, care arde la sfârșitul zilei.
Acolo unde este cenușă, a existat combustie. Acestea sunt în esență compuse din oxizi de carbon și metalici; deși compoziția sa depinde în mod logic de ceea ce a fost combustibilul. Mai jos sunt câteva exemple:
C (s) + ODouă(g) => CODouă(g)
2CO (g) + ODouă(g) => 2CODouă(g)
C3H8(g) + 5ODouă(g) => 3CODouă(g) + 4HDouăO (g)
Fiecare dintre aceste ecuații corespunde arderilor complete; adică tot combustibilul reacționează cu un exces de oxigen pentru a garanta transformarea sa completă.
De asemenea, trebuie remarcat faptul că CODouă si HDouăSau sunt principalele produse gazoase atunci când arde corpurile carbonice (cum ar fi lemnul, hidrocarburile și țesuturile animale). Este inevitabil să se formeze o cantitate de alotrop de carbon, din cauza oxigenului insuficient, precum și a gazelor mai puțin oxigenate, cum ar fi CO și NO.
- Sinteză
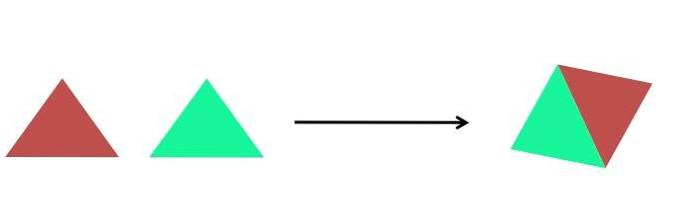
Imaginea de mai sus prezintă o reprezentare extrem de simplă. Fiecare triunghi este un compus sau atom, care se unesc pentru a forma un singur compus; doi triunghiuri formează un paralelogram. Masele cresc și proprietățile fizice și chimice ale produsului sunt, de multe ori, foarte diferite de cele ale reactivilor săi.
De exemplu, arderea hidrogenului (care este și o reacție redox) produce oxid de hidrogen sau hidrură de oxigen; mai cunoscut sub numele de apă:
HDouă(g) + ODouă(g) => 2HDouăO (g)
Când cele două gaze sunt amestecate, la o temperatură ridicată, acestea ard, producând apă gazoasă. Pe măsură ce temperaturile se răcesc, vaporii se condensează pentru a da apă lichidă. Mai mulți autori consideră această reacție de sinteză ca una dintre alternativele posibile pentru înlocuirea combustibililor fosili în obținerea energiei.
Legăturile H-H și O = O se rup pentru a forma două noi legături simple: H-O-H. Apa, așa cum se știe, este o substanță unică (dincolo de sensul romantic), iar proprietățile sale sunt destul de diferite de hidrogenul și oxigenul gazos..
Compuși ionici
Formarea compușilor ionici din elementele lor este, de asemenea, un exemplu de reacție de sinteză. Una dintre cele mai simple este formarea de halogenuri metalice din grupele 1 și 2. De exemplu, sinteza bromurii de calciu:
Ca (s) + BrDouă(l) => CaBrDouă(s)
O ecuație generală pentru acest tip de sinteză este:
M (s) + XDouă => MXDouă(s)
Coordonare
Când compusul format implică un atom metalic în cadrul unei geometrii electronice, se spune apoi că este un complex. În complexe, metalele rămân atașate de liganzi prin legături covalente slabe și se formează prin reacții de coordonare.
De exemplu, avem complexul [Cr (NH3)6]3+. Aceasta se formează atunci când cationul Cr3+ este în prezența moleculelor de amoniac, NH3, care acționează ca liganzi ai cromului:
Cr3+ + 6NH3 => [Cr (NH3)6]3+
Octaedrul de coordonare rezultat în jurul centrului crom metalic este prezentat mai jos:
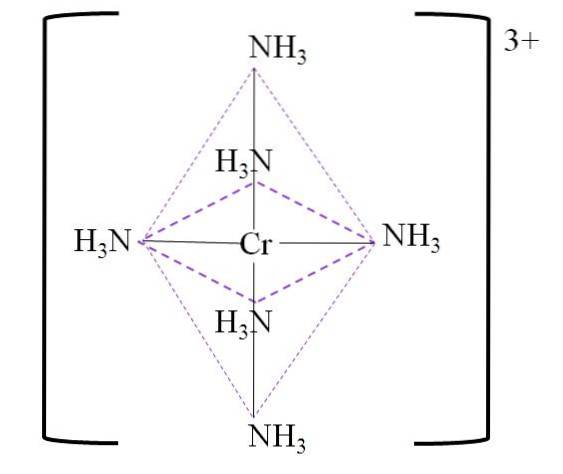
Rețineți că încărcătura de 3+ pe crom nu este neutralizată în complex. Culoarea sa este purpurie și de aceea octaedrul este reprezentat cu acea culoare.
Unele complexe sunt mai interesante, ca în cazul anumitor enzime care coordonează atomii de fier, zinc și calciu.
- Descompunere
Descompunerea este opusul sintezei: un compus se descompune în unul, două sau trei elemente sau compuși.
De exemplu, avem următoarele trei descompuneri:
2HgO (s) => 2Hg (l) + ODouă(g)
2HDouăSAUDouă(l) => 2HDouăO (l) + ODouă(g)
HDouăCO3(ac) => CODouă(g) + HDouăO (l)
HgO este un solid roșiatic care, sub acțiunea căldurii, se descompune în mercur metalic, lichid negru și oxigen..
Peroxidul de hidrogen sau peroxidul de hidrogen suferă descompuneri, dând apă lichidă și oxigen.
Iar acidul carbonic, la rândul său, se descompune în dioxid de carbon și apă lichidă.
O descompunere „mai uscată” este cea suferită de carbonații metalici:
Hoţ3(s) => CaO (s) + CODouă(g)
Vulcanul clasei

O reacție de descompunere care a fost utilizată în clasele de chimie este descompunerea termică a dicromatului de amoniu, (NH4)DouăCrDouăSAU7. Această sare portocalie cancerigenă (deci trebuie manipulată cu mare grijă), arde pentru a elibera multă căldură și produce un solid verde, oxid crom, CrDouăSAU3:
(NH4)DouăCrDouăSAU7(s) => CrDouăSAU3(s) + 4HDouăO (g) + NDouă(g)
- Deplasare
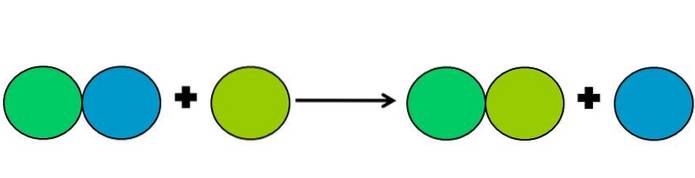
Reacțiile de deplasare sunt un tip de reacție redox în care un element îl deplasează pe altul într-un compus. Elementul deplasat ajunge să reducă sau să câștige electroni.
Pentru a simplifica cele de mai sus, este afișată imaginea de mai sus. Cercurile reprezintă un element. Se observă că cercul verde lime îl deplasează pe cel albastru, rămânând în exterior; dar nu numai asta, ci cercul albastru se micșorează în acest proces, iar cel verde lime ruginește.
De hidrogen
De exemplu, avem următoarele ecuații chimice pentru a expune cele explicate mai sus:
2Al (s) + 6HCI (aq) => AlCI3(aq) + 3HDouă(g)
Zr (s) + 2HDouăO (g) => ZrODouă(s) + 2HDouă(g)
Zn (s) + HDouăSW4(ac) => ZnSO4(ac) + HDouă(g)
Care este elementul deplasat pentru aceste trei reacții chimice? Hidrogen, care este redus la hidrogen molecular, HDouă; trece de la un număr de oxidare de +1 la 0. Rețineți că metalele aluminiu, zirconiu și zinc pot deplasa hidrogenii acizilor și apei; în timp ce cuprul, nici argintul, nici aurul, nu pot.
De metale și halogeni
La fel, există aceste două reacții suplimentare de deplasare:
Zn (s) + CuSO4(ac) => Cu (s) + ZnSO4(ac)
ClDouă(g) + 2NaI (aq) => 2NaCI (aq) + IDouă(s)
În prima reacție, zincul deplasează cuprul metalic mai puțin activ; zincul este oxidat în timp ce cuprul este redus.
În a doua reacție, pe de altă parte, clorul, un element mai reactiv decât iodul, îl deplasează pe acesta din urmă în sarea de sodiu. Aici este invers: cel mai reactiv element este redus prin oxidarea elementului deplasat; prin urmare, clorul este redus prin oxidarea iodului.
- Formarea gazelor
În reacții s-a putut observa că mai multe dintre ele au generat gaze și, prin urmare, ele intră și în acest tip de reacție chimică. De asemenea, reacțiile secțiunii anterioare, cea a deplasării hidrogenului de către un metal activ, sunt considerate reacții de formare a gazelor..
Pe lângă cele menționate deja, sulfurile metalice, de exemplu, eliberează hidrogen sulfurat (care miroase a ouă stricate) atunci când se adaugă acid clorhidric:
N / ADouăS (s) + 2HCI (aq) => 2NaCI (aq) + HDouăS (g)
- Metateză sau dublă deplasare
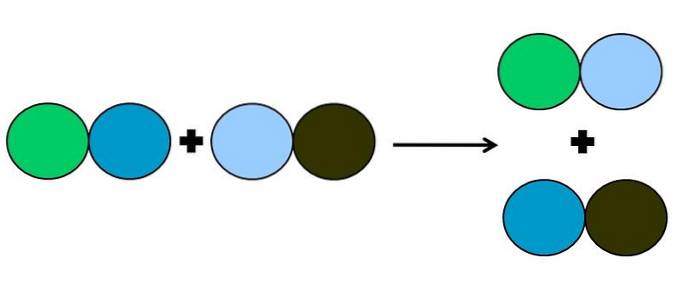
În metateza sau reacția de dublă deplasare, ceea ce se întâmplă este o schimbare de parteneri fără transfer de electroni; adică nu este considerată o reacție redox. După cum se poate vedea în imaginea de mai sus, cercul verde rupe legătura cu cercul albastru închis pentru a face legătura cu cercul albastru deschis.
Precipitare
Când interacțiunile unuia dintre parteneri sunt suficient de puternice pentru a depăși efectul de solvatare al lichidului, se obține un precipitat. Următoarele ecuații chimice reprezintă reacții de precipitare:
AgNO3(aq) + NaCI (aq) => AgCl (s) + NaNO3(ac)
CaClDouă(ac) + NaDouăCO3(ac) => CaCO3(s) + 2NaCl (aq)
În prima reacție, Cl- trece la NO3- pentru a forma clorură de argint, AgCl, care este un precipitat alb. Și în a doua reacție, CO3Două- trece la Cl- pentru a precipita carbonat de calciu.
Acid bazic
Poate că cea mai emblematică reacție de metateză este cea a neutralizării acido-bazice. În cele din urmă, două reacții acido-bazice sunt prezentate ca exemple:
HCI (aq) + NaOH (aq) => NaCI (aq) + HDouăO (l)
2HCI (aq) + Ba (OH)Două(ac) => BaClDouă(aq) + 2HDouăO (l)
OH- deplasează Cl- pentru a forma săruri de apă și clorură.
Exemple de reacții chimice
Mai jos și mai jos, se vor menționa unele reacții chimice cu ecuațiile și comentariile lor respective..
Deplasare
Zn (s) + AgNO3(ac) → 2Ag (s) + Zn (NO3)Două(ac)
Zincul deplasează argintul în sarea sa de nitrați: îl reduce din Ag+ până la Ag. Ca rezultat, argintul metalic începe să precipite în mediu, observat la microscop ca copaci argintii fără frunze. Pe de altă parte, nitratul se combină cu ioni ZnDouă+ rezultând formarea azotatului de zinc.
Neutralizare
Hoţ3(s) + 2HCI (aq) → CaCIDouă(ac) + HDouăO (l) + CODouă(g)
Acidul clorhidric neutralizează sarea de carbonat de calciu pentru a produce o sare, clorură de calciu, apă și dioxid de carbon. CODouă face bule și este detectat în apă. Această clocotire se obține și prin adăugarea de HCl la cretă sau coji de ou, bogate în CaCO3.
NH3(g) + HCI (g) → NH4Cl (s)
În această a doua reacție, vaporii de HCl neutralizează amoniacul gazos. Sarea de clorură de amoniu, NH4Cl, este format ca un fum albicios (imaginea inferioară), deoarece conține particule foarte fine suspendate în aer.

Defilare dublă
AgNO3(aq) + NaCI (aq) → AgCl (s) + NaNO3(ac)
Într-o reacție cu dublă deplasare există un schimb de „parteneri”. Argintul schimbă partenerii cu sodiul. Rezultatul este că noua sare, clorura de argint, AgCl, precipită sub forma unui solid lăptos..
Redox

Există nenumărate reacții redox. Una dintre cele mai impresionante este cea a lui Barkin Dog:
8 NDouăO (g) + 4 CSDouă(l) → S8(s) + 4 CODouă(g) + 8 NDouă(g)
Energia eliberată atunci când se formează cele trei produse stabile este atât de mare încât există un fulger albăstrui (imaginea superioară) și o creștere răsunătoare a presiunii cauzate de gazele originare (CODouă si nDouă).
Și în plus, toate acestea sunt însoțite de un sunet foarte puternic asemănător cu lătratul unui câine. Sulful produs, S8, acoperă pereții interiori ai tubului cu galben.
Ce specie este redusă și care este oxidată? Ca regulă generală, elementele au un număr de oxidare 0. Prin urmare, sulful și azotul din produse trebuie să fie specia care a câștigat sau a pierdut electroni..
Sulful oxidat (electroni pierduți), deoarece avea numărul de oxidare -2 în CSDouă (C4+SDouăDouă-):
SDouă- → S0 + 2e-
În timp ce azotul a fost redus (a câștigat electroni), deoarece avea un număr de oxidare +1 în NDouăPEDouă+SAUDouă-):
2N+ + 2e → N0
Exerciții de reacții chimice rezolvate
- Exercitiul 1
Ce sare precipită în următoarea reacție în mediu apos?
N / ADouăS (ac) + FeSO4(ac) → ¿?
De regulă, toate sulfurile, cu excepția celor formate cu metale alcaline și amoniu, precipită în mediu apos. Se produce o dublă deplasare: fierul se leagă de sulf, iar sodiul de sulfat:
N / ADouăS (ac) + FeSO4(ac) → FeS (s) + NaDouăSW4(ac)
- Exercițiul 2
Ce produse vom obține din următoarea reacție?
Timbru3)Două + Ca (OH)Două →?
Hidroxidul de calciu nu este foarte solubil în apă; dar adăugarea de azotat de cupru ajută la solubilizarea acestuia deoarece reacționează pentru a forma hidroxidul corespunzător:
Timbru3)Două(ac) + Ca (OH)Două(ac) → Cu (OH)Două(s) + Ca (NR3)Două(ac)
Cu (OH)Două recunoscut instantaneu ca un precipitat albastru.
- Exercițiul 3
Ce sare va fi produsă în următoarea reacție de neutralizare?
Al (OH)3(s) + 3HCl (aq) → ¿?
Hidroxidul de aluminiu se comportă ca o bază care reacționează cu acidul clorhidric. Într-o reacție de neutralizare acido-bazică (Bronsted-Lowry), se formează întotdeauna apă, deci celălalt produs trebuie să fie clorură de aluminiu, AlCl3:
Al (OH)3(s) + 3HCI (aq) → AlCI3(aq) + 3HDouăSAU
De data aceasta AlCl3 nu precipită deoarece este o sare (într-o oarecare măsură) solubilă în apă.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Ana Zita. (18 noiembrie 2019). Reacții chimice. Recuperat de pe: todamateria.com
- Kashyap Vyas. (23 ianuarie 2018). 19 Reacții chimice reci care demonstrează știința sunt fascinante. Recuperat de pe: interestingengineering.com
- BeautifulChemistry.net (s.f.). Reacţie. Recuperat de pe: beautifulchemistry.net
- Wikipedia. (2019). Reactie chimica. Recuperat de pe: en.wikipedia.org



Nimeni nu a comentat acest articol încă.