
Caracteristicile rezistenței, structura, funcțiile
rezistin, De asemenea, cunoscut sub numele de factor secretor specific țesutului adipos (ADSF), este un hormon peptidic bogat în cisteină. Numele său se datorează corelației pozitive (rezistenței) pe care o prezintă acțiunii insulinei. Este o citokină care are între 10 și 11 reziduuri de cisteină.
A fost descoperit în 2001 în celulele adipoase (țesut adipos) de șoareci și în celulele imune și epiteliale ale oamenilor, câinilor, porcilor, șobolanilor și mai multor specii de primate..
Indice articol
- 1 Caracteristici generale
- 1.1 La șoareci
- 1.2 La om
- 2 Sinonimie
- 3 Descoperire
- 3.1 FIZZ3
- 3.2 ADSF
- 3.3 Rezistență
- 4 Structuri
- 5 Funcții
- 6 Boli
- 7 Referințe
Caracteristici generale
Rezistina face parte dintr-o familie de molecule de tip rezistină (molecule asemănătoare rezistinei, RELM). Toți membrii familiei RELMs prezintă o secvență N-terminală, care prezintă semnalul de secreție care este între 28 și 44 de reziduuri.
Au o regiune sau zonă centrală variabilă, cu un capăt carboxil terminal, a unui domeniu care variază între 57 și aproximativ 60 de reziduuri, foarte conservate sau conservate și abundente în cisteină..
Această proteină a fost găsită la mai multe mamifere. Cea mai mare atenție a fost îndreptată către rezistina secretată de șoareci și prezentă la om. Aceste două proteine au o asemănare de 53 până la 60% (omologii) în secvențele lor de aminoacizi..
La șoareci
La aceste mamifere, principala sursă de rezistină sunt celulele adipoase sau țesutul adipos alb.
Rezistina la șoareci este bogată în cisteină de 11 kDa. Gena acestei proteine este localizată pe al optulea (8) cromozom. Este sintetizat ca un precursor de 114 aminoacizi. Au, de asemenea, o secvență semnal de 20 de aminoacizi și un segment matur de 94 de aminoacizi..
Rezistența structurală la șoareci are cinci legături disulfură și multiple β-spire. Poate forma complexe de două molecule identice (homodimeri) sau forma proteine cu structuri cuaternare (multimeri) de dimensiuni diferite datorită legăturilor disulfură și nedisulfură.
În oameni
Rezistina umană se caracterizează prin faptul că, la fel ca la șoareci sau alte animale, este o proteină peptidică bogată în cisteină, doar la om este de 12 kDa, cu o secvență matură de 112 aminoacizi.
Gena acestei proteine se găsește pe cromozomul 19. Sursa de rezistină la om este celulele macrofage (celulele sistemului imunitar) și țesutul epitelial. Circulă în sânge ca o proteină dimerică a 92 de aminoacizi legați prin legături disulfidice.

Sinonimie
Rezistina este cunoscută sub mai multe nume, inclusiv: proteină secretată bogată în cisteină FIZZ3 (proteină secretată bogată în cisteină FIZZ3), factor secretor specific țesutului adipos (ADSF), factor secretor specific țesutului adipos (ADSF), proteină bogată în C / EBP -proteină secretată bogată în cisteină secretată de mieloid specifică, proteină secretă bogată în cisteină A12-alfa-like 2 (proteină secretată bogată în cisteină A12- alfa-like 2), RSTN, XCP1, RETN1, MGC126603 și MGC126609.
Descoperire
Această proteină este relativ nouă pentru comunitatea științifică. A fost descoperit independent de trei grupuri de oameni de știință la începutul acestui secol, care i-au dat nume diferite: FIZZ3, ADSF și rezistină..
FIZZ3
A fost descoperit în 2000, în țesutul pulmonar inflamat. Au fost identificate și descrise trei gene de la șoareci și două gene omoloage de la oameni asociate cu producerea acestei proteine..
ADSF
Proteine descoperite în 2001, grație identificării unui factor de secreție bogat în cistină (Ser / Cys) (ADSF) specific țesutului lipidic alb (adipozite).
Această proteină a primit un rol important în procesul de diferențiere de la celule multipotente la adipozite mature (adipogeneza).
Rezistin
Tot în 2001, un grup de cercetători au descris aceeași proteină bogată în cistină din țesutul lipidic matur al șoarecilor, pe care i-au numit rezistină datorită rezistenței sale la insulină..
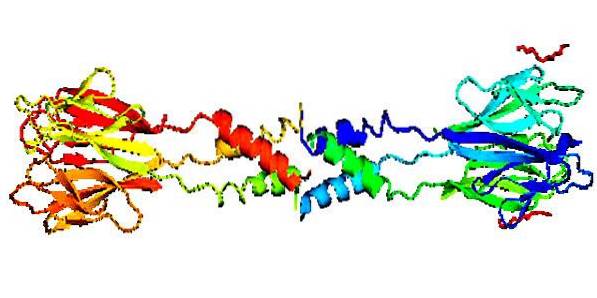
Structuri
Structural, se știe că această proteină este alcătuită dintr-o zonă frontală sau cap în formă de laminar și o zonă posterioară (coadă) în formă elicoidală, formând oligomeri de diferite greutăți moleculare, în funcție de faptul că este umană sau de altă origine..
Are o regiune centrală cu 11 reziduuri de Ser / Cys (Serine / Cisteină) și o zonă bogată și în Ser / Cys a cărei secvență este CX11CX8CXCX3CX10CXCXCX9CCX3-6, unde C este Ser / Cys și X este orice aminoacid.
Are o compoziție structurală considerată neobișnuită, deoarece este formată din mai multe subunități unite prin interacțiuni non-covalente, adică nu utilizează electroni, ci variații electromagnetice dispersate pentru a alcătui structura lor..
Caracteristici
Funcțiile rezistenței, până în prezent, fac obiectul unei ample dezbateri științifice. Printre cele mai relevante descoperiri ale efectelor biologice la om și șoareci se numără:
- Mai multe țesuturi la om și șoareci reacționează la rezistină, inclusiv ficatul, mușchii, inima, imunitatea și celulele adipoase.
- Șoarecii hiperrezistinemici (adică cu niveluri ridicate de rezistență) prezintă o autoreglare a glucozei afectată (homeostazie).
- Rezistina scade absorbția de glucoză stimulată de insulină în celulele musculare ale inimii.
- La celulele imune (macrofage) la om, rezistina induce producția de proteine care coordonează răspunsul sistemului imunitar (citokine inflamatorii)
Boli
La om, se crede că această proteină contribuie fiziologic la rezistența la insulină în diabetul zaharat..
Rolul pe care îl joacă în obezitate este încă necunoscut, deși s-a constatat că există o corelație între creșterea țesutului adipos și nivelurile de rezistină, adică obezitatea mărește concentrația de rezistină în organism. De asemenea, s-a dovedit că este responsabil pentru nivelurile ridicate de colesterol rău din sânge.
Rezistina modulează căile moleculare în patologiile inflamatorii și autoimune. Provoacă în mod direct alterarea funcțională a endoteliului, care la rândul său duce la întărirea arterelor, cunoscută și sub numele de ateroscloroză..
Rezistina funcționează ca un indicator al bolii și chiar ca un instrument clinic predictiv pentru bolile cardiovasculare. Este implicat în producția de vase de sânge (angiogeneză), tromboză, astm, afecțiuni hepatice grase nealcoolice, boli renale cronice, printre altele.
Referințe
- DC Juan, L.S. Kan, C.C. Huang, S.S. Chen, L.T. Ho, L.C. Au (2003). Producerea și caracterizarea rezistinei recombinante bioactive în Escherichia coli. Journal of Biotechnology.
- Rezistența umană. Pospec. Recuperat de la prospecbio.com.
- S. Abramson. Resistim. Recuperat de la collab.its.virginia.edu.
- G. Wolf (2004), Rezistența la insulină și obezitatea: rezistina, un hormon secretat de țesutul adipos. Recenzii nutriționale.
- M. Rodríguez Pérez (2014), Studiul funcțiilor biologice ale S-rezistinei. Raport prezentat Universității Castilla-La Mancha, pentru a aplica pentru titlul de doctor în biochimie. 191.
- A. Souki, N.J. Arráiz-Rodríguez, C. Prieto-Fuenmayor, ... C. Cano-Ponce (2018), Aspecte de bază în obezitate. Barranquilla, Columbia: Edițiile Universității Simón Bolívar. 44 p.
- Md.S. Jamaluddin, S.M. Weakley, Q. Yao și C. Chen (2012). Resistin: roluri funcționale și considerații terapeutice pentru bolile cardiovasculare. British Journal of Pharmacology.
- Am rezistat. Recuperat de pe en.wikipedia.org.
- D.R. Schwartz, M.A. Lazar (2011). Rezistina umană: găsită în traducerea de la șoarece la om. Tendințe în endocrinologie și metabolizare.


Nimeni nu a comentat acest articol încă.