
Structura, proprietățile, utilizările și sinteza salicilatului de metil

salicilat de metil Este o substanță chimică, de natură organică, considerată a fi compusul cu cea mai mare toxicitate dintre salicilații cunoscuți, în ciuda aspectului său incolor și a mirosului plăcut cu o ușoară atingere dulce. Această specie este mai bine cunoscută sub numele de ulei de iarnă.
Se află în stare lichidă în condiții standard de temperatură și presiune (25 ° C și 1 atm), constituind un ester organic care apare în mod natural într-o mare varietate de plante. Din observarea și studiul producției sale în natură, a fost posibil să se treacă la sinteza salicilatului de metil.

Această sinteză a fost realizată prin intermediul unei reacții chimice între esterul acidului salicilic și combinația acestuia cu metanol. În acest fel, acest compus face parte din salvie, vin alb și fructe precum prune și mere, printre altele găsite în mod natural..
Sintetic, salicilatul de metil este utilizat la producerea agenților aromatizanți, precum și la anumite alimente și băuturi..
Indice articol
- 1 Structura chimică
- 2 Proprietăți
- 3 utilizări
- 4 Sinteza
- 5 Referințe
Structura chimică
Structura chimică a salicilatului de metil este alcătuită din două grupe funcționale principale (un ester și un fenol atașat la acesta), așa cum se arată în imaginea de mai sus.
Se observă că este constituit dintr-un inel benzenic (care reprezintă o influență directă asupra reactivității și stabilității compusului), provenind din acidul salicilic din care este derivat..
Pentru a le denumi separat, se poate spune că o grupare hidroxil și un ester metilic sunt atașate în poziția orto (1,2) la inelul menționat anterior..
Apoi, deoarece grupul OH este atașat la inelul benzenic, se formează un fenol, dar grupul care are cea mai înaltă „ierarhie” din această moleculă este esterul, conferind acestui compus o structură specială și, prin urmare, caracteristici destul de specifice..
În acest fel, denumirea sa chimică este prezentată ca 2-hidroxibenzoat de metil, acordat de IUPAC, deși este utilizat mai rar atunci când se referă la acest compus..
Proprietăți
- Este o specie chimică care aparține grupului de salicilați, care sunt produse de origine naturală din metabolismul unor organisme vegetale..
- Sunt cunoscute proprietățile terapeutice ale salicilaților în tratamentele medicale.
- Acest compus este prezent în anumite băuturi, cum ar fi vinul alb, ceaiul, salvia și anumite fructe, cum ar fi papaya sau cireșul..
- Se găsește în mod natural în frunzele unui număr mare de plante, în special în anumite familii.
- Aparține grupului de esteri organici care pot fi sintetizați în laborator.
- Se obține în stare lichidă, a cărei densitate este de aproximativ 1.174 g / ml în condiții standard de presiune și temperatură (1 atm și 25 ° C)..
- Formează o fază lichidă incoloră, gălbuie sau roșiatică, considerată solubilă în apă (care este un solvent anorganic) și în alți solvenți organici.
- Punctul său de fierbere este de aproximativ 222 ° C, manifestându-și descompunerea termică în jurul valorii de 340 până la 350 ° C.
- Are aplicații multiple, variind de la agentul de aromatizare în industria bomboanelor până la analgezice și alte produse din industria farmaceutică.
- Formula sa moleculară este reprezentată ca C8H8SAU3 și are o masă molară de 152,15 g / mol.
Aplicații
Datorită caracteristicilor sale structurale, fiind un ester metilic din acid salicilic, salicilatul de metil are un număr mare de utilizări în diferite zone.
Una dintre principalele utilizări (și cea mai cunoscută) a acestei substanțe este ca agent aromatizant în diferite produse: de la industria cosmetică ca parfum la industria alimentară ca aromă la dulciuri (gumă de mestecat, bomboane, înghețată, printre altele ).
Este, de asemenea, utilizat în industria cosmetică ca agent de încălzire și pentru masajul muscular în aplicații sportive. În acest din urmă caz, acționează ca un factor de risc; adică provoacă roșeață superficială a pielii și a mucoaselor la contactul cu acestea.
În același mod, este utilizat într-o cremă pentru uz local, datorită proprietăților sale analgezice și antiinflamatoare în tratamentele pentru afecțiuni reumatice..
O altă aplicație include utilizarea sa lichidă în sesiunile de aromoterapie, datorită caracteristicilor sale de ulei esențial..
Pe lângă utilizarea sa ca agent de protecție împotriva radiațiilor ultraviolete în produsele de protecție solară, proprietățile sale împotriva luminii sunt cercetate pentru aplicații tehnologice, cum ar fi producerea razelor laser sau crearea de specii sensibile la stocarea informațiilor în molecule..
Sinteză
În primul rând, trebuie menționat faptul că salicilatul de metil poate fi obținut în mod natural din distilarea ramurilor anumitor plante, cum ar fi iarna (Gaultheria procumbens) sau mesteacăn dulce (Betula lentă).
Această substanță a fost extrasă și izolată pentru prima dată în 1843 datorită omului de știință de origine franceză numit Auguste Cahours; din iarnă, se obține în prezent prin sinteză în laboratoare și chiar comercial.
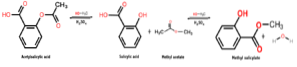
Reacția care are loc pentru a obține acest compus chimic este un proces numit esterificare, în care un ester este obținut prin reacția dintre un alcool și un acid carboxilic. În acest caz, apare între metanol și acid salicilic, după cum se arată mai jos:
CH3OH + C7H6SAU3 → C8H8SAU3 + HDouăSAU
Trebuie remarcat faptul că partea moleculei de acid salicilic care este esterificată cu gruparea hidroxil (OH) a alcoolului este gruparea carboxil (COOH).
Apoi, ceea ce se întâmplă între aceste două specii chimice este o reacție de condensare, deoarece molecula de apă prezentă între reactanți este îndepărtată, în timp ce celelalte specii de reactanți sunt condensate pentru a obține salicilat de metil..
Imaginea următoare prezintă sinteza salicilatului de metil din acidul salicilic, unde sunt prezentate două reacții succesive.
Referințe
- Wikipedia. (s.f.). Salicilat de metil. Recuperat de pe en.wikipedia.org
- Britannica, E. (s.f.). Salicilat de metil. Adus de la britannica.com
- Consiliul Europei. Comitetul de experți în domeniul produselor cosmetice. (2008). Ingrediente active utilizate în cosmetică: sondaj de siguranță. Recuperat de pe books.google.co.ve
- Dasgupta, A. și Wahed, A. (2013). Chimie clinică, imunologie și controlul calității în laborator. Obținut din books.google.co.ve
- PubChem. (s.f.) Salicilat de metil. Recuperat de la pubchem.ncbi.nlm.nih.gov


Nimeni nu a comentat acest articol încă.