
A doua lege a formulelor termodinamice, ecuații, exemple
A doua lege a termodinamicii are diverse forme de exprimare. Unul dintre aceștia afirmă că niciun motor termic nu este capabil să transforme complet toată energia pe care o absoarbe în muncă utilizabilă (formularea Kelvin-Planck). Un alt mod de afirmare este acela de a spune că procesele reale apar într-un astfel de sens încât calitatea energiei este mai mică deoarece entropie tinde să crească.
Această lege, cunoscută și ca al doilea principiu al termodinamicii, a fost exprimată în moduri diferite de-a lungul timpului, de la începutul secolului al XIX-lea până în prezent, deși originile sale datează de la crearea primelor motoare cu aburi din Anglia., La începutul al XVIII-lea.

Dar, deși este exprimată în multe feluri, ideea că materia tinde să se dezordoneze și că niciun proces nu este 100% eficient, deoarece pierderile vor exista întotdeauna..
Toate sistemele termodinamice aderă la acest principiu, începând cu universul însuși cu ceașca de cafea de dimineață care așteaptă în liniște pe masă schimbând căldura cu mediul înconjurător..
Cafeaua se răcește odată cu trecerea timpului, până când se află în echilibru termic cu mediul, așa că ar fi foarte surprinzător dacă într-o zi s-ar întâmpla contrariul și mediul s-ar fi răcit în timp ce cafeaua se încălzea singură. Este puțin probabil să se întâmple, unii vor spune imposibil, dar imaginați-vă doar pentru a vă face o idee despre sensul în care lucrurile se întâmplă spontan.
Într-un alt exemplu, dacă alunecăm o carte pe suprafața unei mese, ea se va opri în cele din urmă, deoarece energia sa cinetică se va pierde ca căldură din cauza fricțiunii..
Prima și a doua lege a termodinamicii au fost stabilite în jurul anului 1850, datorită oamenilor de știință precum Lord Kelvin - creatorul termenului „termodinamică” -, William Rankine - autorul primului text formal despre termodinamică - și Rudolph Clausius..
Indice articol
- 1 Formule și ecuații
- 1.1 Procese reversibile și ireversibile
- 2 Aplicații
- 2.1 Motorul Carnot
- 2.2 Metabolismul uman
- 3 Exemple
- 4 exerciții rezolvate
- 4.1 Exercițiul 1
- 4.2 Exercițiul 2
- 4.3 Exercițiul 3
- 5 Referințe
Formule și ecuații
Entropia - menționată la început - ne ajută să stabilim sensul în care se întâmplă lucrurile. Să ne întoarcem la exemplul corpurilor în contact termic.
Când două obiecte la temperaturi diferite intră în contact și, în cele din urmă, după un timp ating echilibrul termic, acestea sunt conduse spre el de faptul că entropia atinge maximul său, când temperatura ambelor este aceeași.
Denotând entropie ca S, schimbarea entropiei ΔS unui sistem este dat de:

Schimbarea entropiei ΔS indică gradul de tulburare dintr-un sistem, dar există o restricție în utilizarea acestei ecuații: este aplicabilă doar proceselor reversibile, adică acelor în care sistemul poate reveni la starea sa inițială fără a lăsa o urmă a ceea ce s-a întâmplat-.
În procesele ireversibile, a doua lege a termodinamicii apare astfel:

Procese reversibile și ireversibile
Ceașca de cafea se răcește întotdeauna și este un bun exemplu de proces ireversibil, deoarece are loc întotdeauna într-o singură direcție. Dacă adăugați cremă la cafea și scuturați, veți obține o combinație foarte plăcută, dar oricât de mult vă scuturați, nu veți avea cafeaua și smântâna separat, deoarece amestecarea este ireversibilă..

Deși majoritatea proceselor zilnice sunt ireversibile, unele sunt aproape reversibil. Reversibilitatea este o idealizare. Pentru ca acest lucru să aibă loc, sistemul trebuie să se schimbe foarte încet, astfel încât în fiecare punct să fie întotdeauna în echilibru. În acest fel este posibil să-l readuceți la o stare anterioară fără a lăsa urme în împrejurimi..
Procesele apropiate de acest ideal sunt mai eficiente, deoarece oferă o cantitate mai mare de muncă cu un consum mai mic de energie..
Forța de frecare este responsabilă de o mare parte a ireversibilității, deoarece căldura generată de aceasta nu este tipul de energie căutată. În cartea care alunecă peste masă, căldura prin frecare este energie care nu este recuperată.
Deși cartea revine la poziția sa inițială, masa va fi fierbinte ca o urmă de venire și de mers pe ea.
Uită-te acum la un bec cu incandescență: cea mai mare parte a muncii efectuate de curent prin filament este irosită în căldură de efectul Joule. Doar un procent mic este folosit pentru a emite lumină. În ambele procese (carte și bec), entropia sistemului a crescut.
Aplicații
Un motor ideal este unul care este construit utilizând procese reversibile și lipsit de frecare care provoacă risipă de energie, transformându-se aproape toată energia termică în munca utilizabilă.
Subliniem cuvântul aproape, deoarece nici motorul ideal, care este al lui Carnot, nu este 100% eficient. A doua lege a termodinamicii asigură că acest lucru nu este cazul.
Motorul Carnot
Motorul Carnot este cel mai eficient motor care poate fi conceput. Funcționează între două rezervoare de temperatură în două procese izoterme - la temperatură constantă - și două procese adiabatice - fără transfer de energie termică-.
Graficele numite PV-diagrame de presiune-volum- clarifică situația dintr-o privire:
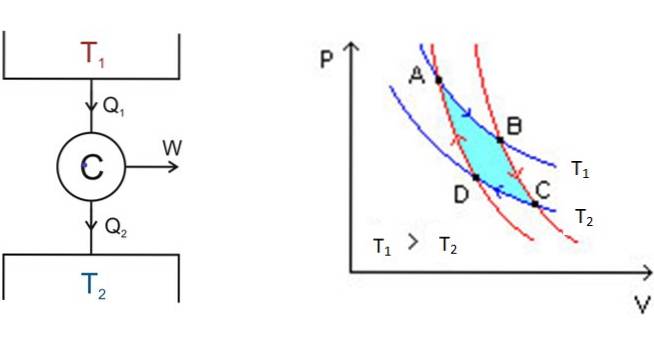
În stânga, în figura 3 este diagrama motorului Carnot C, care ia căldura Q1 a rezervorului care se află la temperatura T1, transformă căldura în lucru W și produce deșeurile QDouă la cel mai rece rezervor, care se află la temperatura TDouă.
Începând de la A, sistemul se extinde până ajunge la B, absorbind căldura la temperatura fixă T1. În B, sistemul începe o expansiune adiabatică în care nu se câștigă sau se pierde căldură, pentru a ajunge la C.
În C începe un alt proces izoterm: cel al transferului căldurii în celălalt depozit termic mai rece care se află la TDouă. Pe măsură ce acest lucru se întâmplă, sistemul este comprimat și ajunge la punctul D. Începe un al doilea proces adiabatic pentru a reveni la punctul de plecare A. În acest fel, un ciclu este finalizat.
Eficiența motorului Carnot depinde de temperaturile în kelvini ale celor două rezervoare termice:
Eficiență maximă = (Qintrare - ÎIeșire) / Qintrare = 1 - (TDouă/ T1)
Teorema lui Carnot afirmă că acesta este cel mai eficient motor termic de acolo, dar nu fi prea rapid să-l cumperi. Vă amintiți ce am spus despre reversibilitatea procesului? Trebuie să se întâmple foarte, foarte încet, astfel încât puterea de ieșire a acestei mașini este practic zero..
Metabolismul uman
Ființele umane au nevoie de energie pentru a-și menține toate sistemele în funcțiune, de aceea se comportă ca niște mașini termice care primesc energie și o transformă în energie mecanică pentru, de exemplu, să se miște.
Eficienţă și corpului uman atunci când faceți lucrări poate fi definit ca coeficientul dintre puterea mecanică pe care o poate furniza și aportul total de energie, care vine împreună cu alimentele.
Ca putere medie Pm este lucrul W realizat într-un interval de timp Δt, poate fi exprimat ca:
Pm = W / Δt
da ΔU / Δt este rata la care se adaugă energia, eficiența corpului este următoarea:
Prin numeroase teste cu voluntari, s-au obținut eficiențe de până la 17%, oferind aproximativ 100 de wați de energie pentru câteva ore.
Desigur, asta va depinde într-o mare măsură de sarcina realizată. Pedalarea unei biciclete este puțin mai eficientă, în jur de 19%, în timp ce sarcinile repetitive care includ lopeți, pioane și sape sunt de până la aproximativ 3%..
Exemple
A doua lege a termodinamicii este implicită în toate procesele care au loc în Univers. Entropia este mereu în creștere, deși în unele sisteme pare să fie în scădere. Pentru ca acest lucru să se întâmple, a trebuit să crească în altă parte, astfel încât în soldul total să fie pozitiv.
- În învățare există entropie. Există oameni care învață lucrurile bine și rapid, pe lângă faptul că le pot aminti ușor mai târziu. Se spune că sunt oameni cu învățare cu entropie scăzută, dar cu siguranță sunt mai puțin numeroși decât cei cu entropie ridicată: cei cărora le este mai greu să-și amintească lucrurile pe care le studiază.
- O companie cu muncitori dezorganizați are mai multă entropie decât una în care muncitorii îndeplinesc sarcini în mod ordonat. Este clar că acesta din urmă va fi mai eficient decât primul.
- Forțele de frecare generează o eficiență mai mică în funcționarea mașinilor, deoarece cresc cantitatea de energie disipată care nu poate fi utilizată eficient.
- Aruncarea unui zar are o entropie mai mare decât aruncarea unei monede. La urma urmei, aruncarea unei monede are doar 2 rezultate posibile, în timp ce aruncarea morții are 6. Cu cât sunt mai multe evenimente, cu atât este mai mare entropia..
Exerciții rezolvate
Exercitiul 1
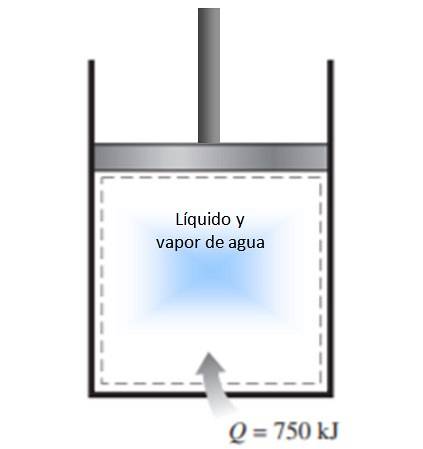
Un cilindru cu piston este umplut cu un amestec de lichid și vapori de apă la 300 K și 750 kJ de căldură este transferat în apă printr-un proces de presiune constantă. Ca rezultat, lichidul din interiorul cilindrului vaporizează. Calculați modificarea entropiei în proces.

Soluţie
Procesul descris în declarație se desfășoară la presiune constantă într-un sistem închis, care nu suferă schimb de masă.
Deoarece este o vaporizare, în timpul căreia nici temperatura nu se schimbă (în timpul schimbărilor de fază temperatura este constantă), definiția modificării entropiei dată mai sus poate fi aplicată și temperatura poate ieși în afara integralei:
ΔS = 750.000 J / 300 K = 2500 J / K.
Întrucât căldura intră în sistem, schimbarea entropiei este pozitivă.
Exercițiul 2
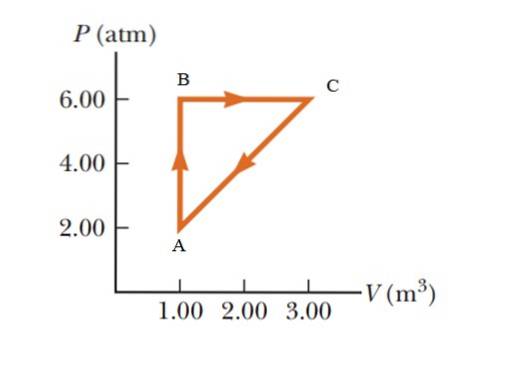
Un gaz suferă o creștere a presiunii de la 2,00 la 6,00 atmosfere (atm), menținând un volum constant de 1,00 m3, și apoi se extinde la presiune constantă până la atingerea unui volum de 3,00 m3. În cele din urmă revine la starea inițială. Calculați cât de mult se lucrează într-un ciclu.

Soluţie
Este un proces ciclic în care variația energiei interne este zero, conform primei legi a termodinamicii, prin urmare Q = W. Într-o diagramă PV (presiune - volum), munca efectuată în timpul unui proces ciclic este egală cu aria închisă de curba. Pentru a da rezultatele în sistemul internațional, este necesar să se facă o schimbare a unității în presiune utilizând următorul factor de conversie:
1 atm = 101,325 kPa = 101,325 Pa.
Aria închisă de grafic corespunde cu cea a unui triunghi a cărui bază (3 - 1 m3) = 2 m3 și a căror înălțime este (6 - 2 atm) = 4 atm = 405.300 Pa
WABCA = ½ (2 m3 x 405300 Pa) = 405300 J = 405,3 kJ.
Exercițiul 3
Una dintre cele mai eficiente mașini construite vreodată se spune că este o turbină cu abur pe cărbune pe râul Ohio, care este utilizată pentru alimentarea unui generator electric care funcționează între 1870 și 430 ° C..
Calculați: a) Eficiența teoretică maximă, b) Puterea mecanică livrată de mașină dacă absoarbe 1,40 x 105 J de energie în fiecare secundă din rezervorul fierbinte. Se știe că eficiența reală este de 42,0%.
Soluţie
a) Eficiența maximă se calculează cu ecuația dată mai sus:
Eficiență maximă = (Qintrare - Î Ieșire) / Qintrare = 1 - (TDouă/ T1)
Pentru a schimba gradele centigrade în grade kelvin, adăugați doar 273,15 la temperatura centigradului:

Înmulțirea cu 100% dă procentajul maxim de eficiență, care este de 67,2%
c) Dacă eficiența reală este de 42%, există o eficiență maximă de 0,42.
Puterea mecanică livrată este: P = 0,42 x 1,40 x10 5 J / s = 58800 W.
Referințe
- Bauer, W. 2011. Fizică pentru inginerie și științe. Volumul 1. Mc Graw Hill.
- Cengel, Y. 2012. Termodinamică. 7ma Ediție. Dealul Mcgraw.
- Figueroa, D. (2005). Seria: Fizică pentru știință și inginerie. Volumul 4. Fluide și termodinamică. Editat de Douglas Figueroa (USB).
- Knight, R. 2017. Fizica pentru oamenii de știință și inginerie: o abordare strategică.
- López, C. Prima lege a termodinamicii. Recuperat de pe: culturacientifica.com.
- Serway, R. 2011. Fundamentele fizicii. 9n / A Cengage Learning.
- Universitatea din Sevilla. Mașini termice. Recuperat de pe: laplace.us.es



Nimeni nu a comentat acest articol încă.