
Istoricul seleniului, proprietăți, structură, obținere, utilizări
seleniu Este un element chimic nemetalic care aparține grupului 16 al tabelului periodic și este reprezentat de simbolul Se. Acest element are proprietăți intermediare între sulf și telur, care sunt membri ai aceluiași grup.
Seleniul a fost descoperit în 1817 de Jöhs J. Berzelius și John G. Gahn, care la vaporizarea piritei au observat un reziduu roșu (imaginea inferioară). La început l-au confundat cu telurul, dar apoi și-au dat seama că au de-a face cu un element nou.

Berzelius a numit noul element seleniu, pe baza numelui „selene” care înseamnă „zeița lunii”. Seleniul este un oligoelement esențial pentru plante și animale, deși în concentrații mari este un element toxic.
Seleniul are trei forme alotropice principale: roșu, negru și gri. Acesta din urmă are proprietatea de a-și modifica conductanța electrică în funcție de intensitatea luminii care o radiază (fotoconductor), pentru care a avut multe aplicații.
Seleniul este distribuit pe scară largă în scoarța terestră, cu toate acestea mineralele care îl conțin nu sunt abundente, deci nu există minerit de seleniu.
Se obține în principal ca un produs secundar al procesului de rafinare a electrolizei cuprului. Seleniul se acumulează în nămolul găsit la anodul celulelor de electroliză.
Ființele umane posedă în jur de 25 de selenoproteine, dintre care unele au o acțiune antioxidantă și controlează generarea de radicali liberi. De asemenea, există aminoacizi de seleniu, cum ar fi selenometionina și selenocisteina.
Indice articol
- 1 Istorie
- 1.1 Prima observație
- 1.2 Descoperire
- 1.3 Originea numelui său
- 1.4 Dezvoltarea aplicațiilor dvs.
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Greutatea atomică standard
- 2.3 Număr atomic (Z)
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Căldura de fuziune
- 2.8 Căldura de vaporizare
- 2.9 Capacitate termică molară
- 2.10 numere de oxidare
- 2.11 Electronegativitate
- 2.12 Energia de ionizare
- 2.13 Ordinea magnetică
- 2.14 Duritate
- 2.15 Izotopi
- 2.16 Alotropie
- 3 Reactivitate
- 3.1 Reacția cu hidrogenul
- 3.2 Reacția cu oxigenul
- 3.3 Reacția cu halogeni
- 3.4 Reacția cu metalele
- 3.5 Seleniți
- 3.6 Acizi
- 4 Structură și configurație electronică
- 4.1 - Seleniul și legăturile sale
- 4.2 - Inele sau lanțuri
- 4.3 - Alotropi
- 5 Unde se găsește și se produce
- 5.1 Electroliza cuprului
- 6 Rolul biologic
- 6.1 Deficiență
- 6.2 Cofactor enzimatic
- 6.3 Proteine și aminoacizi
- 7 Riscuri
- 8 utilizări
- 8.1 Cosmetice
- 8.2 Medici
- 8.3 Electroliza manganului
- 8.4 Pigment
- 8.5 Fotoconductor
- 8.6 Cristale
- 8.7 Vulcanizare
- 8.8 Aliaje
- 8.9 Redresoare
- 9 Referințe
Poveste
Prima observație
Alchimistul Arnold de Villanova ar fi putut observa seleniu în 1230. S-a pregătit în medicină la Sorbona din Paris și a fost chiar doctorul Papei Clement al V-lea..
Villanova în cartea sa Rosarium Philosophorum descrie un sulf roșu sau „rebeum de sulf” care fusese lăsat într-un cuptor după vaporizarea sulfului. Acest sulf roșu ar fi putut fi un alotrop de seleniu.
Descoperire
În 1817, Jöhs Jakob Berzelius și John Gottlieb Gahn au descoperit seleniul într-o uzină chimică pentru producerea de acid sulfuric, lângă Gripsholm, Suedia. Materia primă pentru producerea acidului a fost pirita, care a fost extrasă dintr-o mină Falun..
Berzelius a fost lovit de existența unui reziduu roșu care a rămas în recipientul de plumb după ce sulful a fost ars.
De asemenea, Berzelius și Gahn au observat că reziduul roșu avea un miros puternic de hrean, similar cu cel al telurului. Motiv pentru care el i-a scris prietenului său Marect că ei credeau că depozitul observat este un compus de telur..
Cu toate acestea, Berselius a continuat să analizeze materialul depus când pirita a fost incinerată și a reconsiderat că nu a fost găsit telur în mina Falun. El a concluzionat în februarie 1818 că a descoperit un element nou.
Originea numelui său
Berzelius a subliniat că noul element a fost o combinație de sulf și telur și că similitudinea telurului cu noul element i-a dat ocazia să numească noua substanță seleniu..
Berzelius a explicat că „tellus” înseamnă zeița pământului. Martin Klaport în 1799 a dat acest nume telurului și a scris: „Niciun element unic nu se numește așa. Trebuia făcut! ".
Datorită similitudinii telurului cu noua substanță, Berzelius l-a numit cu cuvântul seleniu, derivat din cuvântul grecesc „selene” care înseamnă „zeița lunii”..
Dezvoltarea aplicațiilor dvs.
În 1873 Willoughby Smith a descoperit că conductivitatea electrică a seleniului depindea de lumina care o radia. Această proprietate a permis seleniului să aibă numeroase aplicații.
Alexander Graham Bell în 1979 a folosit seleniu în fotofonul său. Seleniul produce un curent electric proporțional cu intensitatea luminii care îl luminează, fiind utilizat în contoare de lumină, mecanisme de securitate pentru deschiderea și închiderea ușilor etc..
Utilizarea redresoarelor de seleniu în electronică a început în anii 1930, cu numeroase aplicații comerciale. În anii 1970 a fost înlocuit în redresoare de siliciu.
În 1957 s-a descoperit că seleniul era un element esențial pentru viața mamiferelor, deoarece era prezent în enzime care protejează de oxigenul reactiv și de radicalii liberi. În plus, s-a descoperit existența aminoacizilor precum selenometionina.
Proprietati fizice si chimice
Aspect
Deoarece există mai mulți alotropi pentru seleniu, aspectul său fizic variază. De obicei apare ca un solid roșiatic sub formă de pulbere.
Greutatea atomică standard
78,971 u
Număr atomic (Z)
3. 4
Punct de topire
221 ºC
Punct de fierbere
685 ºC
Densitate
Densitatea seleniului variază în funcție de alotrop sau polimorf. Unele dintre densitățile sale determinate la temperatura camerei sunt:
Gri: 4,819 g / cm3
Alfa: 4,39 g / cm3
Vitros: 4,28 g / cm3
Stare lichidă (punct de topire): 3,99 g / cm3
Căldura de fuziune
Gri: 6,69 kJ / mol
Căldura de vaporizare
95,48 kJ / mol
Capacitatea de căldură molară
25,363 J / (mol K)
Numere de oxidare
Seleniul se poate lega în compușii săi manifestând următoarele numere sau stări de oxidare: -2, -1, +1, +2, +3, +4, +5, +6. Dintre toate, cele mai importante sunt -2 (SeDouă-), +4 (Se4+) și +6 (Se6+).
De exemplu, în SeODouă seleniul are un număr de oxidare de +4; adică se presupune existența cationului Se4+ (Stiu4+SAUDouăDouă-). În mod similar cu SeO3 seleniul are un număr de oxidare de +6 (Se6+SAU3Două-).
În selenură de hidrogen, HDouăSe, seleniul are un număr de oxidare de -2; adică, din nou, se presupune existența ionului sau a anionului SeDouă- (HDouă+stiuDouă-). Acest lucru se întâmplă deoarece seleniul este mai electronegativ decât hidrogenul..
Electronegativitate
2,55 pe scara Pauling.
Energie de ionizare
-Mai întâi: 941 kJ / mol.
-În al doilea rând: 2.045 kJ / mol.
-În al treilea rând: 2.973,7 kJ / mol.
Ordinea magnetică
Diamagnetic.
Duritate
2.0 pe scara Mohs.
Izotopi
Există cinci izotopi naturali și stabili ai seleniului, care sunt prezentați mai jos cu abundențele lor respective:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Alotropie

Seleniul preparat în reacții chimice este o pulbere amorfă roșie de cărămidă, care atunci când se topește rapid dă naștere formei negre vitroase, asemănătoare mărgelelor de rozariu (imaginea de sus). Seleniul negru este un solid fragil și lucios.
De asemenea, seleniul negru este ușor solubil în sulfură de carbon. Când această soluție este încălzită la 180 ° C, precipită seleniu gri, alotropul său cel mai stabil și dens..
Seleniul gri este rezistent la oxidare și este inert la acțiunea acizilor neoxidanți. Principala proprietate a acestui seleniu este fotoconductivitatea sa. Când este iluminat, conductivitatea sa electrică crește cu un factor de 10 până la 15 ori.
Reactivitate
Seleniul din compușii săi există în stările de oxidare -2, +4 și +6. Arată o tendință clară de a forma acizi în stări de oxidare superioare. Compușii care au seleniu cu stare de oxidare -2 se numesc selenide (SeDouă-).
Reacție cu hidrogen
Seleniul reacționează cu hidrogenul pentru a forma hidrogen selenură (HDouăSe), un gaz incolor, inflamabil și mirositor.
Reacția cu oxigenul
Arsurile de seleniu emit o flacără albastră și formează dioxid de seleniu:
stiu8 (s) + 8 ODouă => 8 SeODouă (s)
Oxidul de seleniu este o substanță solidă, albă, polimerică. Hidratarea sa produce acid selenios (HDouăSeO3). De asemenea, seleniul formează trioxid de seleniu (SeO3), analog cu sulful (SO3).
Reacție cu halogeni
Seleniul reacționează cu fluor pentru a forma hexafluorură de seleniu:
stiu8 (s) + 24 F.Două (g) => 8 SeF6 (l)
Seleniul reacționează cu clorul și bromul pentru a forma diclorură de disileniu și respectiv dibromură:
stiu8 (s) + 4 ClDouă => 4 SeDouăClDouă
stiu8 (s) + 4 frDouă => 4 SeDouăFrDouă
Seleniul poate forma și SeF4 și SeCl4.
Pe de altă parte, seleniul formează compuși în care un atom de seleniu se unește cu unul de halogen și altul de oxigen. Un exemplu important este oxiclorura de seleniu (SeODouăClDouă), cu seleniu în stare de oxidare +6, un solvent extrem de puternic.
Reacția cu metalele
Seleniul reacționează cu metalele pentru a forma selenuri de aluminiu, cadmiu și sodiu. Ecuația chimică de mai jos corespunde celei pentru formarea selenurii de aluminiu:
3 Se8 + 16 Al => 8 AlDouăstiu3
Seleniți
Seleniul formează săruri cunoscute sub numele de selenite; de exemplu: selenitul de argint (AgDouăSeO3) și selenit de sodiu (NaDouăSeO3). Acest nume a fost folosit, într-un context literar, pentru a se referi la locuitorii Lunii: seleniții.
Acizi
Cel mai important acid din seleniu este acidul selenic (HDouăSeO4). Este la fel de puternic ca acidul sulfuric și se reduce mai ușor.
Structura și configurația electronică
- Seleniul și legăturile sale
Seleniul are șase electroni de valență, motiv pentru care este situat în grupa 16, la fel ca oxigenul și sulful. Acești șase electroni se află pe orbitalele 4s și 4p, conform configurației lor electronice:
[Ar] 3d10 4sDouă 4p4
Prin urmare, trebuie, ca și sulful, să formeze două legături covalente pentru a-și completa octetul de valență; deși are disponibilitatea orbitalilor săi 4d pentru a se lega cu mai mult de doi atomi. Astfel, trei atomi de seleniu se reunesc și formează două legături covalente: Se-Se-Se.
Seleniul cu cea mai mare masă atomică are o tendință naturală de a forma structuri guvernate de legături covalente; în loc să fie dispuse ca molecule diatomice SeDouă, Se = Se, analog cu ODouă, O = O.
- Inele sau lanțuri
Dintre structurile moleculare pe care le adoptă atomii de seleniu, două pot fi menționate în termeni generali: inele sau lanțuri. Rețineți că în cazul ipotetic al lui Se3, atomii de Se de la capete necesită încă electroni; prin urmare, trebuie să fie legați de alți atomi, succesiv, până când lanțul poate fi închis într-un inel.
Cele mai comune inele sunt inelele cu opt membri sau atomii de seleniu:8 (o coroană selenită). De ce opt? Deoarece cu cât este mai mic inelul, cu atât va suferi mai mult stres; adică unghiurile legăturilor lor se abat de la valorile naturale stabilite de hibridizările lor sp3 (similar cu ceea ce se întâmplă la cicloalcani).
Deoarece există opt atomi, separarea dintre atomii Se-Se este suficientă astfel încât legăturile lor să fie „relaxate” și nu „îndoite”; deși unghiul legăturilor sale este de 105,7º și nu de 109,5º. Pe de altă parte, pot exista inele mai mici:6 și7.
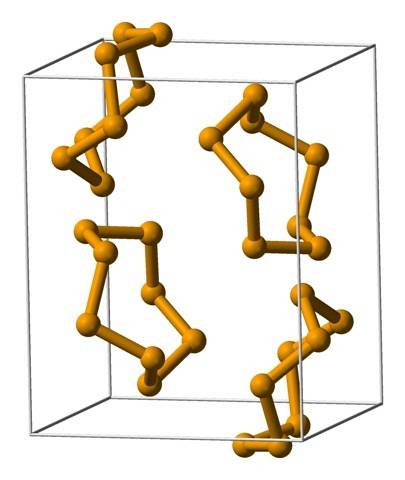
Imaginea de sus prezintă unitățile Se ring.8. Observați asemănarea pe care o au cu coroanele de sulf; numai că ele sunt mai mari și mai grele.
În plus față de inele, atomii de seleniu pot fi aranjați și în lanțuri elicoidale (gândiți-vă la scări în spirală):
La capetele sale pot exista legături duble terminale (-Se = Se) sau inele Se8.
- Alotropii
Luând în considerare faptul că pot exista inele elicoidale sau lanțuri de seleniu și că dimensiunile lor pot varia, de asemenea, în funcție de numărul de atomi pe care le conțin, atunci este evident că există mai mult de un alotrop pentru acest element; adică solide pure de seleniu dar cu structuri moleculare diferite.
Seleniu roșu
Printre cele mai proeminente alotrope de seleniu avem roșu, care poate apărea sub formă de pulbere amorfă sau ca cristale monoclinice și polimorfe (vezi imaginea din Se8).
În seleniul roșu amorf structurile sunt dezordonate, fără modele aparente; în timp ce în lentilă, inelele stabilesc o structură monoclinică. Seleniul cristalin roșu este polimorf, având trei faze: α, β și γ, care diferă prin densitățile lor..
Seleniu negru
Structura seleniului negru constă și din inele; dar nu din opt membri, ci din mulți alții, ajungând până la inele de o mie de atomi (Se1000). Se spune apoi că structura sa este complexă și constă din inele polimerice; unele mai mari sau mai mici decât altele.
Deoarece există inele polimerice de diferite dimensiuni, este dificil să ne așteptăm să stabilească o ordine structurală; deci și seleniul negru este amorf, dar spre deosebire de pulberea roșiatică menționată mai sus, are texturi sticloase, deși este fragilă.
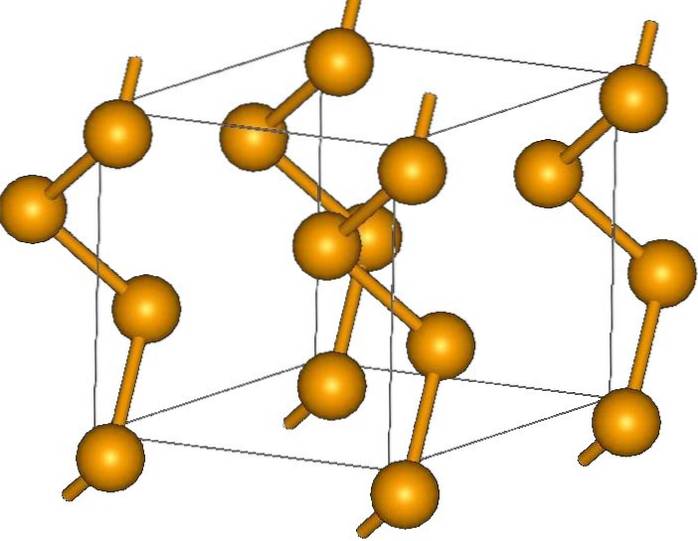
Seleniu gri
Și, în cele din urmă, dintre cei mai simpli alotropi ai seleniului este gri, care se remarcă deasupra celorlalți, deoarece este cel mai stabil în condiții normale și are și un aspect metalic..
Cristalele sale pot fi hexagonale sau trigonale, stabilite de forțele de dispersie londoneze între lanțurile sale elicoidale polimerice (imaginea superioară). Unghiul legăturilor lor este de 130,1º, ceea ce indică o abatere pozitivă de la mediul tetraedric (cu unghiuri de 109,5º)..
De aceea, lanțurile elicoidale de seleniu dau impresia că sunt „deschise”. Prin elucubrație, în această structură atomii se confruntă unul cu celălalt, deci în teorie trebuie să existe o suprapunere mai mare a orbitalilor lor pentru a crea benzi de conducere.
Căldura odată cu creșterea vibrațiilor moleculare dăunează acestor benzi atunci când lanțurile se dezordonează; în timp ce energia unui foton afectează direct electronii, excitându-i și promovându-i tranzacțiile. Din acest punct de vedere, este „ușor” să ne imaginăm fotoconductivitatea seleniului gri..
Unde este localizat și producție
Deși larg distribuit, seleniul este un element rar. Se găsește în starea sa nativă asociată cu sulf și minerale precum eucairit (CuAgSe), claustalit (PbSe), naumanit (AgDouăSe) și crookesite [(CuTiAg)DouăStiu].
Seleniul se găsește ca o impuritate care înlocuiește sulful într-o mică parte din mineralele sulfuroase ale metalelor; precum cuprul, plumbul, argintul etc..
Există soluri în care seleniul există sub formă solubilă de selenați. Acestea sunt transportate de apa de ploaie către râuri și de acolo, spre ocean.
Unele plante sunt capabile să absoarbă și să concentreze seleniu. De exemplu, o cană de nuci de Brazilia conține 544 µg de seleniu, o cantitate care este echivalentă cu 777% din cantitatea zilnică recomandată de seleniu..
La ființele vii, seleniul se găsește în unii aminoacizi, cum ar fi: selenometionina, selenocisteina și metilselenocisteina. Selenocisteina și selenitul sunt reduse la hidrogen selenid.
Electroliza cuprului
Nu există minerit de seleniu. Cea mai mare parte este obținută ca un produs secundar al procesului de rafinare a electrolizei cuprului, fiind găsită în nămolul care se acumulează la anod..
Primul pas este producerea de dioxid de seleniu. Pentru aceasta, nămolul anodic este tratat cu carbonat de sodiu pentru a produce oxidarea acestuia. Apoi se adaugă apă la oxidul de seleniu și se acidulează pentru a forma acid seleniu..
În cele din urmă, acidul selenios este tratat cu dioxid de sulf pentru a-l reduce și a obține seleniu elementar..
Într-o altă metodă în amestecul de nămol și nămol format în producția de acid sulfuric, se obține un seleniu roșu impur care se dizolvă în acid sulfuric..
Se formează apoi acid selenios și acid selenic. Acest acid de seleniu primește același tratament ca și metoda anterioară.
Clorul, care acționează asupra selenidelor metalice, poate fi, de asemenea, utilizat pentru a produce compuși volatili de seleniu clorurați; precum: SeDouăClDouă, SeCl4, SeClDouă și SeOClDouă.
Acești compuși, într-un proces efectuat în apă, sunt transformați în acid selenios, care este tratat cu dioxid de sulf pentru a elibera seleniul..
Rolul biologic
Deficienta
Seleniul este un oligoelement esențial pentru plante și animale, a căror deficiență la om a cauzat tulburări grave, cum ar fi boala Keshan; o boală caracterizată prin afectarea miocardului.
În plus, deficitul de seleniu este asociat cu infertilitatea masculină și poate juca un rol în boala Kashin-Beck, un tip de osteoartrita. De asemenea, deficitul de seleniu a fost observat în artrita reumatoidă.
Cofactor enzimatic
Seleniul este o componentă a enzimelor cu acțiune antioxidantă, cum ar fi glutation peroxidaza și tioredoxin reductaza care acționează pentru eliminarea substanțelor cu oxigen reactiv..
În plus, seleniul este un cofactor al deiodinazelor hormonului tiroidian. Aceste enzime sunt importante în reglarea funcționării hormonilor tiroidieni..
Utilizarea seleniului a fost raportată în tratamentul bolii Hasimoto, o boală autoimună cu formarea de anticorpi împotriva celulelor tiroidiene..
Seleniul a fost, de asemenea, utilizat pentru a reduce efectele toxice ale mercurului, deoarece unele dintre acțiunile sale se exercită asupra enzimelor antioxidante dependente de seleniu..
Proteine și aminoacizi
Omul are aproximativ 25 de selenoproteine care exercită o acțiune antioxidantă pentru protecția împotriva stresului oxidativ, inițiată de un exces de specii reactive de oxigen (ROS) și specii reactive de azot (NOS)..
Prezența aminoacizilor selenometiocină și selenocisteină a fost detectată la om. Selenometionina este utilizată ca supliment alimentar în tratamentul stărilor de deficit de seleniu.
Riscuri
O concentrație mare de seleniu poate avea numeroase efecte dăunătoare asupra sănătății, începând cu părul fragil și unghiile fragile, până la erupții cutanate, căldură, edem al pielii și dureri severe..
Când se tratează seleniul în contact cu ochii, oamenii pot prezenta arsuri, iritații și rupere. Între timp, expunerea prelungită la fum cu un conținut ridicat de seleniu poate provoca edem pulmonar, respirație de usturoi și bronșită..
În plus, persoana poate prezenta pneumonită, greață, frisoane, febră, dureri în gât, diaree și hepatomegalie..
Seleniul poate interacționa cu alte medicamente și suplimente alimentare, cum ar fi antiacide, medicamente antineoplazice, corticosteroizi, niacină și pilule contraceptive..
Seleniul a fost asociat cu un risc crescut de cancer de piele. Un studiu realizat de Institutul Național al Cancerului a constatat că bărbații cu un nivel ridicat de seleniu au fost de două ori mai predispuși să sufere de cancer de prostată agresiv.
Un studiu indică faptul că aportul zilnic de 200 µg de seleniu crește posibilitatea de a dezvolta diabet de tip II cu 50%.
Aplicații
Produse cosmetice
Sulfura de seleniu este utilizată în tratamentul seboreei, precum și a părului gras sau a mătreții.
Medici
Este utilizat ca medicament alternativ în tratamentul bolii Hasimoto, o boală autoimună a tiroidei.
Seleniul reduce toxicitatea mercurului, una dintre activitățile sale toxice se exercită asupra enzimelor deoxidante, care folosesc seleniul ca cofactor.
Electroliza manganului
Utilizarea oxidului de seleniu în electroliza manganului reduce considerabil costurile tehnicii, deoarece reduce consumul de energie electrică.
Pigment
Seleniul este utilizat ca pigment în vopsele, materiale plastice, ceramică și sticlă. În funcție de seleniul utilizat, culoarea sticlei variază de la roșu intens la portocaliu deschis..
Fotoconductiv
Datorită proprietății seleniului gri de a-și schimba conductivitatea electrică în funcție de intensitatea luminii care îl radiază, seleniul a fost utilizat în fotocopiatoare, fotocelule, fotometre și celule solare.
Utilizarea seleniului în fotocopiatoare a fost una dintre principalele aplicații ale seleniului; dar apariția fotoconductoarelor organice a scăzut utilizarea acestora.
Cristale
Seleniul este utilizat pentru decolorarea ochelarilor, ca urmare a prezenței fierului care produce o colorare verde sau galbenă. În plus, permite o colorare roșie a sticlei, în funcție de utilizarea pe care doriți să o dați..
Vulcanizare
Dietilitiocarbonatul de seleniu este utilizat ca agent de vulcanizare în produsele din cauciuc.
Aliaje
Seleniul este utilizat în combinație cu bismutul din alamă pentru a înlocui plumbul; Element foarte toxic care și-a redus utilizarea din cauza recomandărilor organizațiilor de sănătate.
Seleniul este adăugat în concentrații scăzute la aliajele de oțel și cupru pentru a îmbunătăți gradul de utilizare a acestor metale..
Redresoare
Redresoarele cu seleniu au început să fie utilizate în 1933 până în anii 1970, când au fost înlocuite cu siliciu din cauza costului redus și a calității superioare..
Referințe
- Royal Australian Chemical Institute. (2011). Seleniu. [PDF]. Recuperat de pe: raci.org.au
- Wikipedia. (2019). Seleniu. Recuperat de pe: en.wikipedia.org
- Sato Kentaro. (s.f.). Noi alotropi ale elementelor grupului principal. [PDF]. Recuperat de pe: tcichemicals.com
- Dr. Dough Stewart. (2019). Fapte despre elementul de seleniu. Chemicool. Recuperat de pe: chemicool.com
- Robert C. Brasted. (28 august 2019). Seleniu. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Marques Miguel. (s.f.). Seleniu. Recuperat de la: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, dr. (03 iulie 2019). Fapte de seleniu. Recuperat de pe: thoughtco.com
- Lenntech B. V. (2019). Tabel periodic: seleniu. Recuperat de pe: lenntech.com
- Tinggi U. (2008). Seleniul: rolul său de antioxidant în sănătatea umană. Sănătatea mediului și medicina preventivă, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Biroul de suplimente alimentare. (9 iulie 2019). Seleniu: Fișă informativă pentru profesioniștii din domeniul sănătății. Institutul Național de Sănătate. Recuperat de la: ods.od.nih.gov



Nimeni nu a comentat acest articol încă.