
Structură solidă amorfă, proprietăți, exemple
solide amorfe Sunt cei care nu au o structură ordonată pe termen lung. Sunt opusul a ceea ce este cunoscut sub numele de solid cristalin. Particulele sale sunt asociate într-un mod dezordonat, similar cu cel al lichidelor, dar cu suficientă forță pentru a se uni într-o structură solidă..
Acest personaj amorf este mai des întâlnit decât ai putea crede; este de fapt una dintre stările posibile pe care le poate adopta materia condensată. Cu aceasta se înțelege că orice compus capabil să se solidifice și, prin urmare, să cristalizeze, poate, de asemenea, să se aglomereze într-un mod dezordonat dacă condițiile experimentale o permit..

Cele menționate anterior se aplică de obicei substanțelor pure, indiferent dacă sunt elemente sau compuși. Dar este valabil și în cazul amestecurilor. Multe amestecuri solide sunt amorfe, cum ar fi vata de zahăr, ciocolată, maioneză sau piure de cartofi..
Faptul că un solid este amorf nu îl face mai puțin valoros decât unul cristalin. Tulburarea structurală îi conferă uneori proprietăți unice pe care nu le-ar prezenta într-o stare cristalină. De exemplu, în industria fotovoltaică este preferat siliciul amorf decât cel cristalin pentru anumite aplicații la scară mică.
Indice articol
- 1 Structura solidelor amorfe
- 2 Proprietăți
- 3 Pregătirea
- 4 Exemple de solide amorfe
- 4.1 Minerale și materiale plastice
- 4.2 Țesutul biologic
- 4.3 Pahare
- 4.4 Carbon și metale
- 5 Referințe
Structura solidelor amorfe
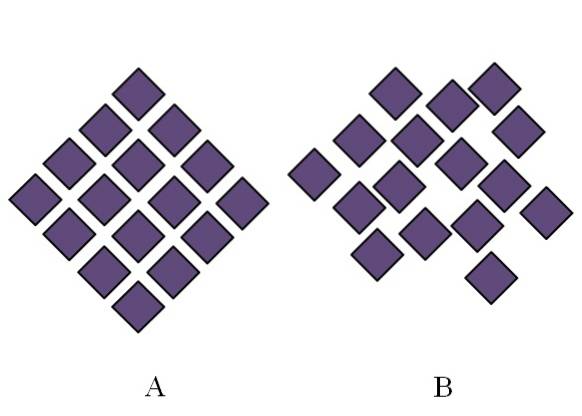
Structura unui solid amorf este dezordonată; îi lipsește periodicitatea sau modelul structural. Imaginea de mai sus ilustrează acest punct. A corespunde unui solid cristalin, în timp ce B reprezintă un solid amorf. Rețineți că în B diamantele mov sunt aranjate în mod arbitrar, chiar dacă atât în A cât și în B există același tip de interacțiuni.
Dacă se observă și B, se va vedea că există spații care par a fi goale; adică structura are defecte sau nereguli. Prin urmare, o parte a tulburării microscopice sau interne a unui solid amorf se datorează faptului că particulele sale sunt „aranjate” în așa fel încât structura rezultată are multe imperfecțiuni..
La început s-a menționat domeniul de aplicare al gradului de ordonare a solidelor amorfe. În B există doar câteva romburi care par a fi bine aliniate. Pot exista regiuni ordonate; dar numai la distanță scurtă.
Se spune apoi că un solid amorf este alcătuit din mici cristale incomensurabile de structuri diferite. Suma tuturor acestor structuri ajunge să devină labirintică și fără sens: structura globală devine amorfă, alcătuită din nesfârșite blocuri cristaline împrăștiate peste tot..
Proprietăți
Proprietățile unui solid amorf variază în funcție de natura particulelor sale constitutive. Cu toate acestea, există anumite caracteristici generale care pot fi menționate. Solidele amorfe pot fi vitroase, atunci când prezintă aspecte similare cristalelor; sau gelatinoase, rășinoase sau prăfuite.
Deoarece structurile lor sunt dezordonate, ele nu generează spectre fiabile de difracție a razelor X. De asemenea, punctele lor de topire nu sunt precise, ci acoperă mai degrabă o serie de valori..
De exemplu, punctul de topire pentru un solid amorf poate varia de la 20 la 60 ° C. Între timp, solidele cristaline se topesc la o anumită temperatură sau într-un interval îngust dacă conțin multe impurități..
O altă caracteristică a solidelor amorfe este că atunci când se rup sau se fracturează, nu produc fragmente geometrice cu fețe plate, ci fragmente neregulate cu fețe curbate. Când nu sunt vitroși, apar ca niște corpuri prăfuite și opace.
Pregătirea
Mai degrabă decât un solid amorf, acest concept ar trebui tratat ca o „stare amorfă”. Toți compușii (ionici, moleculari, polimerici, metalici etc.) sunt capabili, într-o anumită măsură, și dacă condițiile experimentale o permit, să formeze solide amorfe și necristaline..
De exemplu, în sinteze organice compușii solizi sunt obținuți inițial ca mase pulverulente. Conținutul său de impurități este atât de mare încât îi afectează ordinea moleculară pe termen lung. De aceea, atunci când produsul se recristalizează iar și iar, solidul devine din ce în ce mai cristalin; își pierde caracterul amorf.
Acest lucru nu înseamnă totuși că solidele amorfe sunt neapărat materiale impure; mai multe dintre ele sunt amorfe prin natura lor chimică.
O substanță pură se poate solidifica amorf dacă lichidul său este răcit brusc, în așa fel încât particulele sale să nu cristalizeze, ci să adopte o configurație sticloasă. Răcirea este atât de rapidă încât particulele nu au suficient timp pentru a găzdui blocurile cristaline care abia reușesc să „se nască”.
Apa, de exemplu, este capabilă să existe într-o stare sticloasă, amorfă și nu doar ca gheață.
Exemple de solide amorfe
Minerale și materiale plastice

Practic orice material cristalin se poate conforma cu o formă amorfă (și invers). Acest lucru se întâmplă cu unele minerale, care din motive geochimice nu și-au putut stabili formal cristalele convenționale. Altele, în schimb, nu formează cristale, ci sticlă; acesta este cazul obsidianului.
Pe de altă parte, polimerii tind să se solidifice amorf, deoarece moleculele lor sunt prea mari pentru a defini o structură ordonată. Aici intră rășini, cauciucuri, spumă de polistiren (anime), materiale plastice, teflon, bakelită, printre altele..
Țesut biologic
Solidele biologice sunt în mare parte amorfe, cum ar fi: țesutul organelor, pielea, părul, corneea etc. La fel, grăsimile și proteinele formează mase amorfe; totuși, cu o pregătire adecvată, poate cristaliza (cristale ADN, proteine, grăsimi).
Ochelari

Deși a rămas aproape ultima dată, cel mai reprezentativ solid amorf este de departe sticla în sine. Compoziția sa este în esență aceeași cu cea a cuarțului: SiODouă. Atât cristalul de cuarț, cât și sticla sunt rețele covalente tridimensionale; numai că rețeaua de sticlă este dezordonată, cu legături Si-O de diferite lungimi.

Sticla este solidul amorf prin excelență și se spune că materialele care au un aspect similar au o stare sticloasă..
Carbon și metale
Avem cărbune amorf, cărbunele activ fiind unul dintre cele mai importante datorită capacităților sale absorbante. La fel, există siliciu amorf și germaniu, cu aplicații electronice în care acționează ca semiconductori..
Și, în cele din urmă, există aliaje amorfe care nu stabilesc o structură cristalină din cauza disparității atomilor lor de metal..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Rachel Bernstein și Anthony Carpi. (2020). Proprietățile solidelor. Recuperat de pe: visionlearning.com
- Wikipedia. (2020). Solid amorf. Recuperat de pe: en.wikipedia.org
- Richard Zallen, Ronald Walter Douglas și alții. (31 iulie 2019). Solid amorf. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Elsevier B.V. (2020). Solid amorf. ScienceDirect. Recuperat de pe: sciencedirect.com
- Danielle Reid. (2020). Solid amorf: definiție și exemple. Studiu. Recuperat de la: study.com
- Cubul lui Rubik. (2008). Ce este un material amorf? Recuperat de pe: web.physics.ucsb.edu


Nimeni nu a comentat acest articol încă.