
Structura chimică, proprietăți și utilizări ale sulfatului de amoniu

sulfat de amoniu Este o sare anorganică ternară amoniacală a acidului sulfuric. Formula sa chimică este (NH4)DouăSW4. Prin urmare, proporțiile stoichiometrice spun că pentru fiecare anion sulfat există doi cationi de amoniu care interacționează cu acesta. Aceasta permite neutralitatea sării ((+1) ∙ 2 + (-2)).
Nomenclatura sa se datorează faptului că este o sare derivată din HDouăSW4, schimbând sufixul „uric” cu „ato”. Astfel, cei doi protoni inițiali sunt înlocuiți cu NH4+, produs de reacție cu amoniac (NH3). Deci, ecuația chimică pentru sinteza sa este: 2 NH3 + HDouăSW4 => (NH4)DouăSW4
Sulfatul de amoniu este un tampon de azot și sulf, ambele esențiale în chimia solului și îngrășăminte..
Indice articol
- 1 Structura chimică
- 2 Proprietăți fizice și chimice
- 2.1 Greutatea moleculară
- 2.2 Aspect fizic
- 2.3 Miros
- 2.4 Punct de topire
- 2.5 Solubilitate
- 2.6 Densitate
- 2.7 Presiunea vaporilor
- 2.8 Punct de aprindere
- 2,9 pH
- 2.10 Stabilitate
- 2.11 Descompunerea
- 2.12 Coroziune
- 3 utilizări
- 3.1 În agricultură
- 3.2 Ca reactiv analitic
- 3.3 În precipitarea și izolarea proteinelor
- 3.4 În industrie
- 3.5 Alte utilizări
- 4 Referințe
Structura chimică
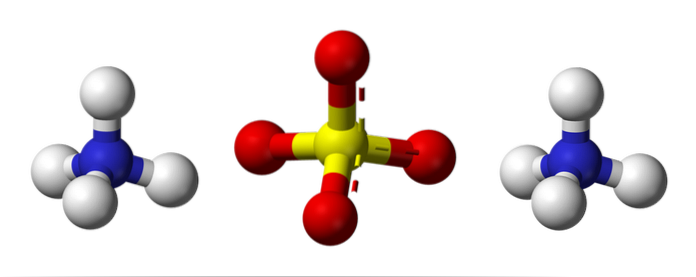
Imaginea de sus ilustrează geometriile moleculare ale ionilor NH4+ Așadar4Două-. Sferele roșii corespund atomilor de oxigen, sferele albe atomilor de hidrogen, albastrului atomului de azot și galbenului atomului de sulf.
Ambii ioni pot fi considerați ca doi tetraedri, având astfel trei unități care interacționează pentru a forma un aranjament cristal ortorombic. Anionul sulfat este SO4Două- și este capabil să doneze sau să accepte patru legături de hidrogen, la fel ca cationul NH4+.
Proprietati fizice si chimice
Greutate moleculară
132,134 g / mol.
Aspectul fizic
Alb solid. Cristale ortorombice albe sau maronii, în funcție de nivelurile de impuritate.
Miros
Toaletă.
Punct de topire
280 ° C. Acest punct de topire, scăzut în comparație cu alți compuși ionici, se datorează faptului că este o sare cu cationi monovalenți (+1) și cu ioni diferiți în dimensiunile lor, determinând solidul să aibă o energie de rețea cristalină scăzută..
Solubilitate
76,4 g / 100 g apă la 25 ° C. Această afinitate pentru apă se datorează capacității mari a moleculelor sale de a solvata ionii de amoniu. Pe de altă parte, este insolubil în acetonă și alcool; adică în solvenți mai puțin polari decât apa.
Densitate
1,77 g / cm3 la 25 ° C.
Presiunea de vapori
1.871 kPa la 20 ° C.
Punct de aprindere
26 ° C.
pH
5,0-6,0 (25 ° C. Soluție 1M). PH-ul ușor acid se datorează hidrolizei NH4+ în apă, producând H3SAU+ la concentrații scăzute.
Stabilitate
Stabil în condiții de mediu adecvate. În contact cu oxidanții puternici se poate aprinde.
Descompunere
Începe să se descompună la 150 ° C, eliberând vapori toxici de oxid de sulf, oxid de azot și amoniu.
Coroziune
Nu atacă fierul sau aluminiul.
Aplicații

În agricultură
- Sulfatul de amoniu este utilizat ca îngrășământ în solurile alcaline. Sarea de amoniu are în compoziția sa 21% azot și 24% sulf. Cu toate acestea, există compuși care furnizează o cantitate mai mare de azot decât sulfatul de amoniu; avantajul acestuia din urmă este concentrația sa ridicată de sulf.
- Sulful este esențial în sinteza proteinelor, deoarece mai mulți aminoacizi - precum cistina, metionina și cisteina - au sulf. Din aceste motive, sulfatul de amoniu continuă să fie unul dintre cele mai importante îngrășăminte.
- Se folosește în culturile de grâu, porumb, orez, bumbac, cartofi, cânepă și pomi fructiferi.
- Scade pH-ul solurilor alcaline datorită contribuției sale la procesul de nitrificare efectuat de microbi. Amoniu (NH4+) pentru a produce azotat (NO3-) și eliberați H+: 2NH4+ + Al 4-leaDouă => 2NO3- + 2HDouăO + 4H+. Creșterea concentrației de hidrogen scade pH-ul solurilor alcaline și permite o utilizare mai mare.
- Pe lângă utilizarea sa ca îngrășământ, sulfatul de amoniu acționează ca un adjuvant la insecticidele solubile, erbicidele și fungicidele, care sunt pulverizate pe culturi..
- Sulfatul este capabil de sechestrarea ionilor prezenți în sol și în apa de irigație, care sunt necesari pentru viața anumitor agenți patogeni. Printre ionii pe care îi captează sulfatul de amoniu se numără CaDouă+, MgDouă+, credinţăDouă+ și credința3+. Această acțiune îmbunătățește efectul microbicid al agenților menționați..
Ca reactiv analitic
Sulfatul de amoniu acționează ca un agent de precipitare în analiza electrochimică, în mediul de cultură microbiologic și în prepararea sărurilor de amoniu..
În precipitarea și izolarea proteinelor
Sulfatul de amoniu este utilizat în izolarea și purificarea proteinelor, în special a celor din plasmă. O cantitate de sulfat de amoniu este adăugată în plasmă pentru a o aduce la o anumită concentrație; astfel, este cauzată precipitarea unui grup de proteine.
Precipitatul este colectat prin centrifugare și o cantitate suplimentară de sulfat de amoniu se adaugă la supernatant și, la o nouă concentrație, are loc precipitarea unui alt grup de proteine..
Repetarea procesului anterior într-un mod secvențial permite ca rezultat obținerea diferitelor fracții de proteine plasmatice.
Înainte de apariția noilor tehnologii de biologie moleculară, această procedură permitea izolarea proteinelor plasmatice de mare importanță în medicină, de exemplu: imunoglobuline, factori de coagulare etc..
În industrie
Sulfatul de amoniu acționează prin întârzierea declanșării focului în industria textilă. Este utilizat ca aditiv în industria galvanizării. Este, de asemenea, utilizat la producerea de peroxid de hidrogen, clorură de amoniu etc..
Alte utilizări
- Sulfatul de amoniu este utilizat ca agent de reglare a presiunii osmotice și ca agent de precipitare a sării..
- Sub formă de laurilsulfat de amoniu, reduce tensiunea superficială a apei, permițând astfel separarea contaminanților prin creșterea durității apei..
- Este un agent anticoroziv.
- Este folosit ca aditiv alimentar care reglează aciditatea din aluatul de făină și din pâine.
Referințe
- PEID OCDE. (Octombrie 2004). Sulfat de amoniu. [PDF]. Adus pe 27 aprilie 2018, de pe: inchem.org
- Compania Mozaic. (2018). Sulfat de amoniu. Adus pe 27 aprilie 2018, de pe: cropnutrition.com
- Wikipedia. (2018). Sulfat de amoniu. Adus pe 27 aprilie 2018, de pe: en.wikipedia.org
- Pubchem. (2018). Sulfat de amoniu. Adus pe 27 aprilie 2018 de la: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23 iulie 2015). [Figura]. Adus pe 27 aprilie 2018 de pe: flickr.com
- Paula Papp. (22 februarie 2017). Aplicații și utilizări ale sulfatului de amoniu. Adus pe 27 aprilie 2018 de la: business.com

Nimeni nu a comentat acest articol încă.