
Structura, proprietățile, producția, utilizările sulfurii de calciu (CaS)

sulfură de calciu Este un solid anorganic format din elementul calciu (Ca) și elementul sulf (S), formula chimică este CaS. Este un solid alb-gălbui solubil în apă, care se găsește în natură la unii vulcani și la unii meteoriți sub forma unui mineral numit oldhamit..
Când CaS se dizolvă în apă, formează diverși compuși datorită ionului sulfură SDouă- devine ion SH- și se formează ioni OH-. Soluția rezultată este alcalină. Acest compus este utilizat ca bază pentru compușii care sunt luminescenți sau care produc lumină vizibilă în anumite condiții. Aceste materiale sunt utilizate și în vopselele luminoase.

CaS a fost considerat un posibil medicament pentru tratarea problemelor inimii și vaselor de sânge, cum ar fi hipertensiunea arterială sau hipertensiunea arterială, care este o boală care afectează o mare parte a populației lumii.
Cu sulfura de calciu pot fi obținuți alți compuși, cum ar fi azotatul de calciu și carbonatul de calciu. Trebuie manipulat cu precauție și în contact cu umiditatea atmosferei, poate produce HDouăS care este foarte toxic.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 4 Proprietăți chimice
- 4.1 Soluție apoasă
- 4.2 Compuși prezenți când sunt dizolvați în apă
- 4.3 Reacția cu acizii
- 4.4 Alte reacții
- 5 Obținerea
- 5.1 Prezența în natură
- 6 utilizări
- 6.1 În materiale luminoase
- 6.2 În medicină
- 6.3 În obținerea altor compuși
- 6.4 Alte aplicații
- 7 Riscuri
- 8 Referințe
Structura
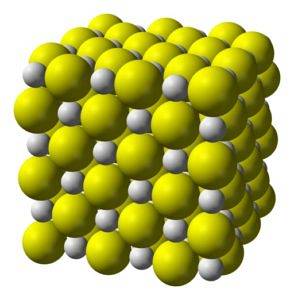
Sulfura de calciu este un compus extrem de ionic format dintr-un ion de calciu CaDouă+ și un ion sulfură SDouă-.
Cristalizează într-o structură cubică ca sarea de rocă.
Nomenclatură
- Sulfura de calciu
Proprietăți fizice
Starea fizică
Cristale solide cristaline de culoare alb-gălbuie, cubice, precum cele ale clorurii de sodiu.
Greutate moleculară
72,144 g / mol
Punct de topire
2528 ºC
Densitate
2,59 g / cm3
Solubilitate
Solubil în apă. Insolubil în etanol.
Proprietăți chimice
Soluție apoasă
Pe măsură ce CaS se dizolvă în apă, se separă în ionii săi de calciu. Două+ și sulf SDouă-. Acesta din urmă ia un proton și devine ionul hidrosulfură SH- eliberând un ion hidroxil OH-.
SDouă- + HDouăO ⇔ SH- + Oh-
Prin urmare, soluțiile de sulf de calciu CaS sunt alcaline (au un pH bazic) și nu au ioni S.Două- dar SH-.
Doar atunci când o cantitate mare de alcalii, cum ar fi hidroxidul de sodiu NaOH, este adăugată la soluție, echilibrul se deplasează spre formarea ionilor de sulf SDouă-.

SH- poate lua un alt proton H+ din apă, formând hidrogen sulfurat, care este un compus foarte toxic.
SH- + HDouăO ⇔ HDouăS + OH-
Din acest motiv, în apă se formează cantități mici de H.DouăDa și când este expus la umiditatea din mediu, CaS degajă un miros neplăcut tipic hidrogenului sulfurat.
Compuși prezenți când sunt dizolvați în apă
Rezultatul reacțiilor din apă indicate mai sus este că se formează Ca (SH)Două, Ca (OH)Două și Ca (SH) (OH).
CaS + HDouăO → Ca (SH) (OH)
Ca (SH) (OH) + HDouăO → Ca (OH)Două + HDouăS
Reacție cu acizi
Aceleași reacții care apar în apă determină reacția CaS cu acizii care formează HDouăS.
CaS + 2 HCI → CaClDouă + HDouăS
Alte reacții
Dacă o soluție de sulfură de calciu este încălzită cu sulf, se obțin ionii de polisulfură S.4Două- și S3Două-.
Dacă CaS este încălzit în aer uscat sau oxigen pur, compusul se oxidează în sulfat de calciu CaSO3 și apoi la sulfat de calciu CaSO4:
2 CaS + 3 ODouă → 2 CaSO3
2 CaSO3 + SAUDouă → 2 CaSO4
Cu agenți oxidanți precum cloratul de potasiu KClO3, azotat de potasiu KNO3 sau dioxid de plumb PbODouă apar reacții violente.
Obținerea
Sulfura de calciu poate fi preparată prin calcinarea (încălzirea la o temperatură foarte ridicată) a elementelor calciu (Ca) și sulf (S) într-o atmosferă inertă, adică nu există oxigen sau vapori de apă, de exemplu..
Ca + S + căldură → CaS
Poate fi obținut și prin încălzirea sulfatului de calciu CaSO4 cu cărbune:
Caz4 + 2 C → CaS + 2 CODouă
Cu toate acestea, în ultimul caz nu se obține un CaS pur, deoarece reacționează suplimentar cu CaSO4 formând CaO și SODouă.
CaS este generat și prin arderea deșeurilor de cărbune.
Prezență în natură
CaS este prezent în mod natural în mineralul oldhamit. Aceasta este o componentă a unor meteoriți și este importantă pentru cercetările științifice efectuate asupra sistemului solar..
Se crede că Oldhamitul s-a format prin condensare în nebuloasa care a originat sistemul solar. Este prezent și în vulcani.

În plus, sulfura de calciu este produsă natural prin reducerea CaSO4 (tencuială) posibil datorită acțiunii bacteriilor.
Aplicații
În materiale luminoase
Una dintre cele mai răspândite utilizări ale sulfurii de calciu a fost ca bază pentru compușii luminescenți. Acestea sunt substanțe care emit lumină vizibilă în anumite circumstanțe..
În compușii luminescenți ai CaS, acesta acționează ca bază și activatorii sunt adăugați la structură, cum ar fi clorurile anumitor elemente, cum ar fi ceriu (Ce3+) și europiu (EuDouă+).
Materialul rezultat din unirea CaS și activator este utilizat de exemplu în ecrane cu tuburi catodice care alcătuiesc vechile ecrane ale computerelor sau computerelor sau televizoarelor vechi.

Ele sunt, de asemenea, utilizate în lămpile cu diode emițătoare de lumină curente sau cu LED-uri. Diode emitatoare de lumina).

Aceste materiale sunt folosite și în vopselele și lacurile luminoase..
În medicină
Sulfura de calciu a fost considerată în studiile științifice medicale ca un medicament pentru tratamentul hipertensiunii arteriale (presiune ridicată în artere). Aceasta este o boală care afectează sistemul cardiovascular al multor persoane (inima și vasele de sânge).
CaS este considerat un „donator” de HDouăS. Aceasta joacă un rol important în reglarea tonusului sau puterii vaselor de sânge, astfel încât administrarea de CaS ar putea fi un posibil remediu pentru tratarea hipertensiunii.

În obținerea altor compuși
Sulfura de calciu face posibilă prepararea altor compuși precum azotatul de calciu Ca (NO3)Două:
CaS + 2 HNO3 → Ca (NR3)Două + HDouăS
De asemenea, a fost utilizat pentru a obține carbonat de calciu CaCO3. Pentru a face acest lucru, o soluție apoasă de CaS este supusă carbonatării cu CODouă:
CaS + HDouăO + CODouă → HDouăS + CaCO3
Alte aplicatii
Sulfura de calciu este, de asemenea, utilizată ca aditiv lubrifiant și ca agent de flotație în extracția mineralelor..
Riscuri
Sulfura de calciu poate provoca iritarea pielii, a ochilor și a căilor respiratorii. Trebuie manipulat cu precauție și cu echipamente de siguranță adecvate.
Este un compus foarte toxic pentru viața acvatică, deci este periculos pentru aceste medii.
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Lide, D.R. (editor). (2005). Manualul de chimie și fizică al CRC. 85a CRC Press.
- Ropp, R.C. (2013). Grupa 16 (O, S, Se, Te) Compuși alcalini-pământeni. Sulfură de calciu. În Enciclopedia compușilor alcalini ai pământului. Recuperat de la sciencedirect.com.
- Li, Y.F. și colab. (2009). Sulfura de calciu (CaS), un donator de hidrogen sulfurat (H (2) S): un nou medicament antihipertensiv? Med Hypotheses, septembrie 2009; 73 (3): 445-7. Recuperat de la ncbi.nlm.nih.gov.
- Casa J.E. și House, K.A. (2016). Sulf, seleniu și telur. Apariția sulfului. În chimia anorganică descriptivă (ediția a treia). Recuperat de la sciencedirect.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Sulfură de calciu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- De Beer, M. și colab. (2014). Conversia sulfurii de calciu în carbonat de calciu în timpul procesului de recuperare a sulfului elementar din deșeurile de gips. Waste Manag, 2014 noiembrie; 34 (11): 2373-81. Recuperat de la ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.